IV. Ионные механизмы нервного импульса (потенциала действия)
Внутриклеточная регистрация электрической активности нервных клеток показала, что распространяющийся нервный импульс, или потенциал действия (ПД), возникает при деполяризации нейронов до критического уровня, который можно рассматривать как порог генерации импульса (Brock, Coombs a. Eccles., 1952; Frank a. Fuortes, 1956; Kolmodin a. Skoglund, 1958; Spencer a. Kandel, 1961; Костюк и Семенютин, 1961, и многие другие). В естественных условиях подобная деполяризация развивается при возбуждении нейрона или, говоря конкретнее, при возникновении ВПСП. В эксперименте деполяризацию нейрона можно получить пропусканием выходящего тока через микроэлектрод. Для регистрации искусственно вызванной деполяризации пользуются вторым микроэлектродом, который погружают в ту же клетку, или вторым каналом двухканального микроэлектрода (Coombs, Eccles a. Fatt, 1955a).
В связи с тем, что в механизмах распространения ПД существенную роль играют кабельные свойства мембраны, ионные закономерности развития нервного импульса наиболее удобно рассмотреть на длинном отростке нейрона - аксоне, так как в нем кабельные свойства выражены наиболее отчетливо.
Как известно, для вызова нервных импульсов широко используется электрическое раздражение нервов, которые представляют собой в большинстве случаев совокупность аксонов мотонейронов и дендритов афферентных нервных клеток. Последние по своим физиологическим свойствам практически не отличаются от аксонов.
Если раздражающий электрический ток подводится к нерву с помощью биполярных электродов, то изменения, которые он производит у анода и катода, носят противоположный характер. Для простоты рассмотрим изменения, происходящие при этом в одиночном нервном волокне.
На рис. 25 схематически изображена мембрана аксона, его внутренняя и внешняя среда. На некотором расстоянии от мембран расположены катод и анод, подводящие к аксону постоянный ток. Линиями со стрелками показано направление тока и, в самом схематическом виде, характер распределения его плотности. Естественно, что значительная часть тока течет от анода к катоду по внеклеточной жидкости, обладающей высокой проводимостью (низким сопротивлением). Однако известная часть тока все же проникает через мембрану аксона в район анода и направляется далее по высокопроводящей внутриклеточной жидкости к тому участку внутренней поверхности мембраны, который расположен под катодом. При прохождении тока под анодом снаружи внутрь через мембрану, обладающую относительно высоким сопротивлением, на ней возникает падение напряжения (разность потенциалов) с положительным значением на наружной поверхности и отрицательным на внутренней. Таким образом, аксон в районе анода гиперполяризуется. В районе катода ток проходит через мембрану в обратном направлении, т. е. изнутри наружу, и возникающее при этом падение напряжения на мембране имеет противоположное значение: изнутри мембрана заряжается положительно, а снаружи отрицательно. Благодаря этому под катодом происходит деполяризация мембраны. Этим объясняется давно установленное физиологами возбуждающее действие катода, в известном смысле сходное с возбуждающей синаптической активацией. Как и синаптическая деполяризация, катодная деполяризация, будучи доведенной до критического (порогового) уровня, вызывает появление распространяющегося ПД. Подпороговая деполяризация, вызванная катодом, повышает возбудимость нервного волокна, приближая уровень его поляризации к критическому. Гиперполяризация, возникающая под анодом, напротив, понижает его возбудимость, отодвигая МП от критического уровня.
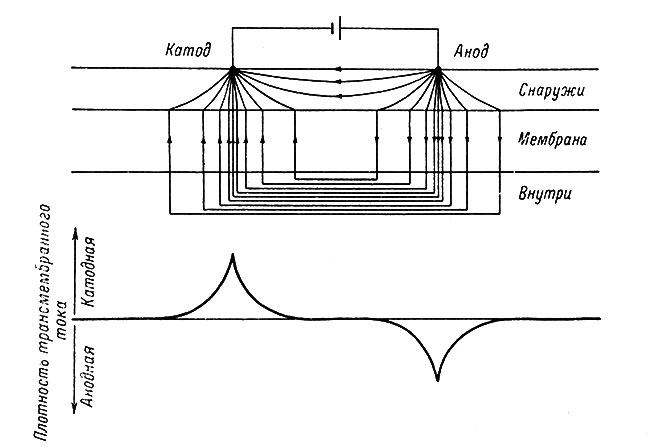
Рис. 25. Схема распределения тока в нервном волокне во время пропускания постоянного тока от внешнего источника. (Woodbury a. Patton, 1963). Внизу дана кривая, иллюстрирующая плотность распределения тока у катода и анода по длиннику волокна
Мембрана нервного волокна обладает не только омическим сопротивлением, но также и емкостью. Располагаясь между двумя относительно хорошо проводящими субстанциями (вне- и внутриклеточная жидкости, представляющие собой электролиты), она формирует вместе с ними конденсатор, в котором вне- и внутриклеточная жидкости являются обкладками, а сама мембрана - "диэлектриком".
Емкостные свойства мембраны существенно влияют на временное течение и пространственное распределение разности потенциалов, возникающей на ней при прохождении тока. Последний должен нейтрализовать какую-то часть зарядов на той или иной стороне мембраны в зависимости от своего направления, в результате чего внутри волокна возникает де- или гиперполяризация. Если представить себе, что под катодом (выходящий ток) переносчиками зарядов являются положительные ионы, то они должны перемещаться изнутри волокна наружу. Мембрана создает на их пути некоторое препятствие (сопротивление). Поэтому на внутренней стороне мембраны при данном постоянном токе положительных ионов будет всегда несколько больше ("затор перед плотиной"), чем на ее наружной стороне. Эти "избыточные" положительные ионы и будут частично деполяризовывать (разряжать) отрицательно заряженную внутреннюю поверхность мембраны. Если рассматривать в качестве переносчиков зарядов отрицательные ионы, то они, двигаясь под катодом в обратном направлении (снаружи внутрь), будут скапливаться по тем же причинам на наружной стороне мембраны и уменьшать ее положительный заряд (т. е. разряжать наружную обкладку конденсатора). Это также приводит к снижению трансмембранной разности потенциалов, хотя и другим путем. Аналогичные рассуждения можно повторить относительно событий, разыгрывающихся под анодом. Не отличаясь принципиально, все явления будут иметь там обратный знак.
Как известно, даже для частичной разрядки конденсатора током требуется время, так что мембрана, являясь конденсатором, замедляет изменения трансмембранной разности потенциалов при прохождении через нее тока.
В нервном волокне (как впрочем и в нервной клетке в меньшей степени) развиваются также своеобразные пространственные изменения разности потенциалов, возникающих при прохождении тока через мембрану. Аксоплазма все же обладает известным сопротивлением. При достаточном расстоянии между электродами оно может становиться огромным. Благодаря этому между различными участками аксоплазмы возникают значительные разности потенциалов. Если в одном из участков волокна, например под катодом, возникла деполяризация мембраны, то токи из окружающих недеполяризованных участков потекут по межклеточной жидкости к зоне деполяризации, затем через мембрану и далее по аксоплазме в обратную сторону к месту своего возникновения, но с другой стороны (рис. 26). Встречая сопротивление аксоплазмы, поток зарядов (ток) все более и более уменьшается и замедляется по мере удаления от катода, и соответственно этому уменьшаются по величине и замедляются во времени изменения разности потенциалов по сравнению с параметрами разности потенциалов на мембране у катода. Естественно, что аналогичные изменения обратного знака происходят у анода. Таким образом, изменения МП, вызываемые прохождением тока через мембрану, наиболее велики в месте возникновения этого тока (в данном случае в области электрода) и убывают по мере удаления от источника тока. Это убывание носит экспоненциальный характер, вначале снижаясь круто, а затем все медленнее с увеличением расстояния от зоны максимальной разности потенциалов. Описанные свойства нервного проводника получили название кабельных в связи с тем, что аналогичными свойствами обладают подводные телефонные кабели. На рис. 27 приводится схема, иллюстрирующая эти свойства.*
* (В целях упрощения здесь не приводится более строгого изложения кабельных свойств мембраны и подробно не излагаются представления о постоянных времени, длины и пространства. Желающие могут ознакомиться с этим вопросом в ряде руководств, в частности в "Нейрофизиологии" Т. Ру и соавторов (Ruch et al., 1963). )
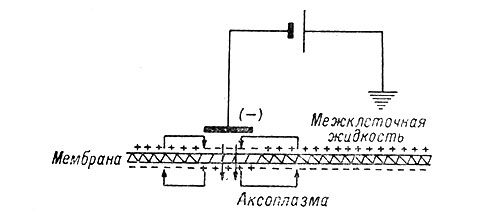
Рис. 26. Движение местных токов в районе катода
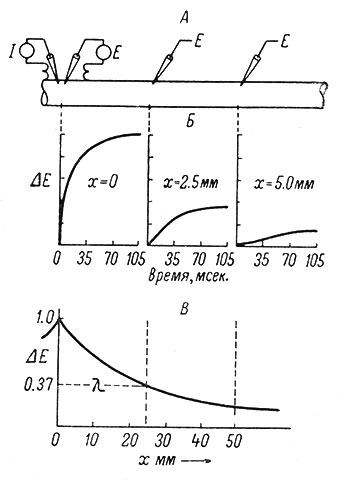
Рис. 27. Кабельные свойства нервного волокна. (Woodbury a. Patton, 1963). А - схема эксперимента. Внезапно включенный ток течет от источника (I), расположенного слева, через микроэлектрод и мембрану аксона и вновь возвращается к источнику через второй электрод, расположенный в окружающем аксон растворе. Изменения трансмембранного потенциала (ΔЕ) в различных точках аксона измеряются системой внутриклеточных электродов Е. Б - изменения трансмембранного потенциала как функции времени, записанные электродами, введенными в нервное волокно на различном расстоянии от поляризующего электрода. Эти расстояния отмечены прерывистым продолжением осей ординат. По мере увеличения расстояния потенциал нарастает все более медленно и достигает все меньших конечных значений. В - изменения конечных величин ΔЕ как функция расстояния вдоль волокна; λ - постоянная длины волокна, является мерой крутизны падения конечных величин потенциала по мере удаления от источника тока, вызвавшего развитие потенциала в волокне
Следует отметить, что в физиологической литературе электрические феномены, связанные с кабельными свойствами мембраны нервных и мышечных клеток, часто описываются словами "электротон", "электротонические" или "поляризационные" потенциалы. Ходжкин и Раштон (Hodgkin a. Rushton, 1946) приводят ряд веских соображений против использования этих терминов. Однако они весьма распространены и в настоящее время.
Вернемся к механизмам генерации ПД. Представим себе, что в нервное волокно введен двухканальный электрод. Один из каналов используется для регистрации трансмембранной разности потенциалов, а через другой пропускаются прямоугольные толчки выходящего, деполяризующего тока (рис. 28). Подпороговый импульс такого тока в силу кабельных свойств мембраны лишь постепенно доводит деполяризацию волокна до максимума. Возникшая деполяризация уменьшается тоже постепенно со скоростью, определяемой постоянной времени* мембраны (рис. 28, Б, 2). При увеличении интенсивности деполяризующего тока характер деполяризационного процесса несколько изменяется. Деполяризация начинает развиваться несколько быстрее и уменьшается медленнее, чем это следовало бы из кабельных свойств мембраны (рис. 28, Б, 3а). Создается впечатление, что процесс деполяризации получает какую-то поддержку, нарушающую его закономерный ход. Дополнительное увеличение выходящего тока может довести вызванную деполяризацию до критической (пороговой) величины, и в этом случае вместо постепенного уменьшения деполяризация круто нарастает и переходит в ПД (рис. 28, 3б), во время которого происходит временная реверсия потенциала (внутренняя поверхность мембраны приобретает положительный заряд по отношению к внеклеточной жидкости). Как показали исследования Ходжкина, Хаксли и Катца (Hodgkin a. Huxley, 1952a, 1952b, 1952c; Hodgkin, Huxley a. Katz, 1952), при развитии деполяризации начинает возрастать специфическая проницаемость постсинаптической мембраны по отношению к ионам Na+ (рис. 29). Ввиду того что наружная концентрация ионов Na+ во много раз превышает их внутриклеточную концентрацию, эти ионы начинают усиленно поступать в нервное волокно или в нейрон, и тем самым поддерживают возникшую деполяризацию (ионы Na+ заряжены положительно, и их поступление внутрь клетки снижает ее отрицательный заряд). Этим и объясняется отклонение деполяризации к подпороговой зоне от обычного ее хода.
* (Постоянная времени (τ) является характеристикой любой электрической цепи, состоящей, как и мембрана, из сопротивления (R) и емкости (С), и определяется временем, необходимым для достижения в цепи напряжения, равного 2/3 разности потенциалов, поданной в цепь от источника постоянного тока. Математически зависимость между постоянной времени, сопротивлением и емкостью записывается формулой τ = RC.)
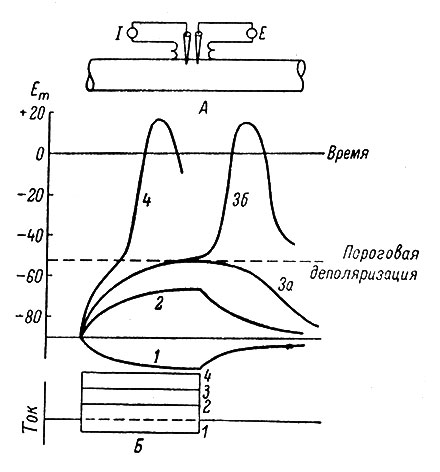
Рис. 28. Порог или критический уровень деполяризации. (Woodbury a. Patton, 1963). А - схема экспериментальной установки со стимулирующим (I) и отводящим (Е) микроэлектродами. Б - изменения в мембранном потенциале Еm (верхние кривые 1, 2, 3а, 3б, 4), вызванные внезапно включенным и продолжающимся некоторое время постоянным током (нижние кривые 1, 2, 3, 4). Нижняя кривая 1 (прямо угольный гиперполяризующий толчок тока) вызывает изменения мембранного потенциала, изображаемое верхней кривой 1 (гиперполяризационные изменения мембранного потенциала) и так далее для кривых 2-4
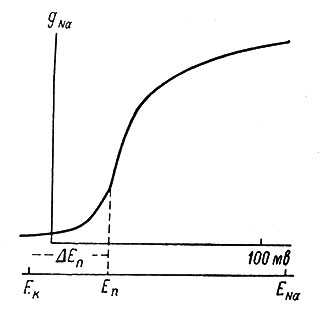
Рис. 29. Влияние внезапных изменений мембранного потенциала на натриевую проводимость (проницаемость) мембраны. (Hodgkin a. Huxley, 1952a). По оси ординат - максимальная натриевая проводимость мембраны (GNa), измеренная тотчас после внезапного смещения мембранного потенциала; по оси абсцисс: ΔЕ - величина смещения мембранного потенциала от исходного уровня; ΔЕn - пороговая деполяризация, при которой входящий поток Na+ равен сумме выходящего потока К+ и входящего потока Cl-; Ek - потенциал равновесия для К+; ЕNа - потенциал равновесия для Na+. Исходный уровень МП равен приблизительно -60 мв. Измерения сделаны на гигантском аксоне кальмара с помощью методики фиксации мембранного потенциала
При критическом уровне деполяризации входящий деполяризующий поток ионов Na+ полностью уравновешивает реполяризующие потоки Сl- и К+. Возникает неустойчивое состояние, когда даже незначительное увеличение деполяризации сопровождается дополнительным увеличением натриевой проводимости (проницаемости) постсинаптической мембраны и количество входящих ионов Na+ возрастает еще больше. Это сопровождается дальнейшим нарастанием деполяризации, в результате чего величина натриевого потока еще резче увеличивается и процесс приобретает лавинообразный характер в связи с наличием положительной обратной связи между натриевой проводимостью и деполяризацией:
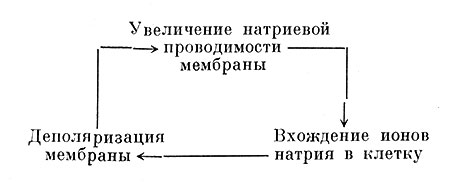
Специфическая проницаемость постсинаптической мембраны для натрия на время создает условия для резкого возрастания внутриклеточной концентрации Na+, в результате чего заряд клетки меняется на обратный, приближаясь к потенциалу равновесия для натрия, т. е. к такому потенциалу, который уравновешивал бы градиент концентрации Na+ между вне- и внутриклеточной средой. Если "покоящаяся" постсинаптическая мембрана, легко проницаемая для К+, может при некотором упрощении и схематизации явлений рассматриваться как "калиевая мембрана", то в активированном состоянии она превращается в "натриевую мембрану", наиболее легко проницаемую для Na+. В покоящемся нервном волокне (или клетке) МП близок к потенциалу равновесия для калия, а в период активности МП стремится к потенциалу равновесия для натрия, вследствие чего и возникает реверсия внутриклеточного потенциала. Однако в период реверсии ENa полностью не достигается, поскольку повышенная натриевая проводимость быстро исчезает (меньше, чем через 1 мсек.), а калиевая проводимость возрастает, что приводит к быстрой реполяризации нервного волокна. Тонкие механизмы повышения натриевой проницаемости при деполяризации, ее быстрой инактивации и вторичного увеличения калиевой проницаемости при реверсии МП пока еще не известны, но сам факт подобных изменений проницаемости постсинаптической мембраны экспериментально установлен с помощью методики фиксации МП (Hodgkin, Huxley a. Katz, 1952; Hodgkin a. Huxley, 1952a, 1952b, и др.).
ПД является регенеративным, саморегулирующимся процессом. Возникнув однажды, он в силу кабельных свойств мембраны вызывает местную деполяризацию в соседних участках, которая, достигая критической величины, вызывает в этом участке специфическое увеличение натриевой проницаемости и развитие ПД, который в свою очередь вызывает описанный цикл в последующем участке. Благодаря этому ПД со значительной скоростью бездекрементно распространяется в виде волны по всей длине аксона, как бы заново рождаясь в каждом новом месте. Эти особенности распространения ПД лежат в основе закона "все или ничего", характеризующего физиологическую активность нервных и мышечных (поперечнополосатых) клеток.
При возникновении в нейроне синаптически вызванной деполяризации события развиваются аналогично. Достигая критического уровня, она генерирует распространяющийся импульсный процесс в постсинаптической мембране, который традиционно принято называть распространяющимся возбуждением.
Механизм бездекрементно распространяющихся импульсов обеспечивает передачу сведений о происшедших в теле нейрона изменениях, точнее о сверхпороговой деполяризации на значительные расстояния - к последующим нейронам или эффекторам. Возник этот механизм, по-видимому, в ходе эволюции животного мира, как приспособление для передачи нервных процессов на большие расстояния без существенной потери информации (Grundfest, 1957, 1959; Раштон, 1961; Вартанян и Василевский, 1964а, и др.). Дальнейшим развитием этого механизма явилось увеличение скорости проведения импульсов у позвоночных (приблизительно в 20 раз) благодаря появлению у нервных волокон миелиновой оболочки.
Все описанные выше явления характерны для немиелинизированных волокон беспозвоночных. В мякотных волокнах импульсы распространяются скачкообразно. Миелиновая оболочка создает вокруг нервных волокон изоляцию с малой емкостью. Она прерывается через каждые 2 мм в районе перехватов Ранвье. Отношение между длиной миелинизированного участка волокна (от перехвата до перехвата) и его диаметром равно приблизительно 100:1. Контакт между мембраной аксона и внеклеточной жидкостью осуществляется только в области перехватов. Имеются доказательства, что местный ток течет от перехвата к перехвату, в результате чего ПД как бы прыгает через 2 мм, что значительно ускоряет его распространение (рис. 30). Следует отметить, что амплитуда ПД в 5-7 раз превышает пороговую величину, необходимую для активации соседнего перехвата Ранвье. Это соотношение получило название "гарантийного фактора" (safety factor) генерации нервного импульса (Тасаки, 1953; Tasaki, 1964, и др.).
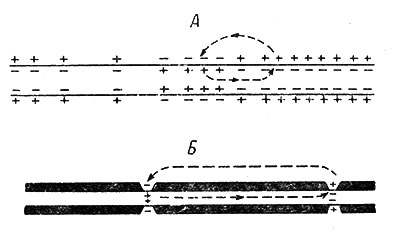
Рис. 30. Схема распространения нервного импульса в безмякотных (А) и мякотных (Б) нервных волокнах. (Hodgkin, 1958)
Для правильного представления о величине ионнообменных реакций при развитии импульсной активности целесообразно привести некоторые количественные данные, характеризующие эти ионные потоки.* Оказывается, что входящий поток ионов Na+ и выходящий поток ионов К+, создающие временную реверсию МП и его реполяризацию и лежащие в основе ПД, существенно не меняют внутриклеточную концентрацию этих ионов. Действительно, для формирования восходящей фазы ПД необходимо перемещение внутрь клетки такого количества ионов Na+, которое могло бы изменить заряд мембраны с уровня, близкого к ЕK, до уровня, близкого к ENa. Заряд мембраны определяется ее емкостью и существующим на ней напряжением. Весьма простые расчеты показывают, что, например, для аксона кальмара достаточно всего 1.6 × 10-12 М ионов Na+ и К+ для формирования одного импульса. В эксперименте с помощью радиоактивных изотопов Na+ и К+ было показано, что при развитии одного импульса в аксоне кальмара в него входит 4 × 10-12 ионов Na+ и выходит 3 × 10-12 ионов К+ на 1 см2 (Hodgkin a. Keynes, 1955). Изменения концентрации ионов внутри аксона зависят от количества поступивших и покинувших его ионов и от объема аксоплазмы. Чем толще волокно, тем меньше возникающие изменения концентрации. Так, в аксоне кальмара, имеющего диаметр порядка 500 мк, поступление Na+ в количестве 3 × 10-12 М на 1 см2 при развитии одного ПД повышает его внутреннюю концентрацию всего лишь на 1.5 × 10-10 М на 1 см3. В то же время внутренняя концентрация Na+ в этом аксоне составляет около 50 × 10-6 М на 1 см3, т. е. приблизительно в 300000 раз выше. Для волокна с диаметром 50 мк внутренняя концентрация натрия при аналогичных условиях изменяется лишь на 1/30000 т. е. крайне несущественно. Только проведение 30000 импульсов может удвоить концентрацию натрия в таком волокне при условии прекращения активного переноса Na+ изнутри наружу. В немиелинизированном аксоне с диаметром 0.1 мк один ПД может изменить внутреннюю концентрацию натрия уже на 10%. В этих условиях деятельность механизмов активного выведения Na+ должна быть очень напряженной. В то же время частота импульсации порядка десятков и coтeн импульсов в секунду является обычным явлением в ц. н. с. млекопитающих. В связи с этим делается понятным резкое возрастание обмена веществ в ц. н. с. при ее деятельном состоянии и высокий уровень окислительных метаболических процессов в мозгу, на что указывалось в первой главе настоящей книги.
* (Приводимый цифровой материал взят главным образом из "Нейрофизиологии" Т. Ру и соавторов (Ruch et al., 1963).)
Как видно из изложенного, ионные механизмы распространяющегося нервного импульса (ПД) существенно отличаются от ионных механизмов нейронного возбуждения (ВПСП). Эти процессы разыгрываются на разных субстратах: ВПСП является результатом изменений, происходящих в субсинаптической мембране, ПД - результатом изменений в постсинаптической (внесинаптической) мембране. Единственной общей чертой этих двух процессов является временная деполяризация мембраны, однако и амплитудные, и временные параметры деполяризации при ВПСП и при развитии ПД совершенно отличны. Все это позволяет разделить нейронное возбуждение (ВПСП) и импульсную активность на явления различных категорий, а не объединять их термином "возбуждение", говоря об одном процессе, как о местном возбуждении (ВПСП), а о другом - как о распространяющемся (ПД). Принципиальное значение разделения центрального, нейронного возбуждения (ВПСП) и "распространяющегося возбуждения" (нервного импульса, ПД) будет подробно освещено в дальнейшем, после рассмотрения ионных механизмов центрального торможения.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'