IV. Роль нейроглии в функционировании нейрона
1. Предпосылки для биохимического исследования нейроглии
Выраженная морфологическая неоднородность нервной ткани явилась мощным стимулом для активного внедрения в практику нейрохимических исследований методов микрохимического и цитохимического анализа. При этом основным объектом исследования явились нервные клетки. Лишь в самые последние годы внимание исследователей стали все больше привлекать и клетки нейроглии.
Анализ биоэлектрической активности основных структур нервной ткани позволил ряду физиологов высказаться о несомненном участии нейроглии в осуществлении специфической активности нейрона (Galambos, 1961; Ройтбак, 1963). Де Робертис развивает представление о том, что глиальные клетки во многих отношениях представляют собой фактически гемато-энцефалический барьер (De Robertis a. Gerschenfeld, 1961).
Наконец, приведенные выше данные цитохимического анализа ферментов нервной клетки свидетельствуют об отсутствии некоторых важных ферментов (таких, например, как аденозинтрифосфатаза, карбоангидраза и др.), необходимых для активного функционирования любой ткани и в особенности - ткани с интенсивными, быстро изменяющимися по величине и направлению процессами обмена веществ. Это позволило высказать предположение о том, что нейрон является лишь частью единой метаболической системы нейрон-нейроглия. В наиболее законченном виде такое предположение было выдвинуто Хиденом (Hyden, 1960, 1962), а затем детально исследовано и обосновано им и его сотрудниками (Hyden, 1964). За последние годы анализ биохимических процессов в нейроглии проводится и в других лабораториях, в результате чего накоплен некоторый материал, характеризующий биохимические особенности глиальных клеток.
2. Химический состав клеток нейроглии
Прежде всего нужно оговорить, что глиальные клетки не однородны; их подразделяют на макроглию, происходящую, как и нейроны, из нервной трубки, и микроглию, имеющую мезенхимальное происхождение. Объектом нейрохимического исследования является, как правило, макроглия, клетки которой в свою очередь делят на астроциты и олигодендроглиоциты. Между этими двумя типами макроглии существуют, несомненно, биохимические отличия, но это требует отдельного рассмотрения. Здесь же речь пойдет в основном об олигодендроглии - клетках-сателлитах.
Содержание плотных веществ (сухой вес) в глиальных клетках спинного мозга и подкорковых узлов головного мозга в целом такое же, как ив нейронах этих отделов (Hyden, 1960, 1962, 1964); в ткани верхнего шейного симпатического ганглия, по нашим данным, полученным методом микроинтерферометрии, содержание плотных веществ в олигодендроглиоцитах несколько выше, чем в теле симпатических нейронов. Белок в глиальных клетках отличается от белка нейронов меньшим содержанием гистидина, триптофана, тирозина и аргинина (Португалов, 1958).
Содержание ДНК в клетках макроглии, по данным ультрафиолетовой цитоспектрофотометрии, равно 6.2 пг (Певзнер, Томина, Чайка, 1964), т. е. соответствует клеткам с диплоидным набором хромосом. Как видно из гистограммы (рис. 7), небольшая часть глиальных клеток, по-видимому, содержит тетраплоидное количество ДНК, однако, учитывая ошибку метода, мы не можем пока сделать окончательного заключения на этот счет. В некоторых участках головного мозга человека Лэфему и Джонстону (Lapham, a. Johnstone, 1963) удалось с достоверностью показать присутствие определенного процента глиальных клеток с тетраплоидными ядрами.

Рис. 7. Содержание ДНК в клетках макроглии головного мозга человека. (Певзнер, Томина, Чайка, 1964). По оси абсцисс - количество ДНК, в пг, на одну клетку; по оси ординат - соответствующее данному количеству ДНК число клеток, в % от их общего количества
Содержание РНК в клетках нейроглии весьма мало. По нашим цитоспектрофотометрическим данным, общее количество нуклеиновых кислот в глиальных клетках-сателлитах верхнего шейного симпатического ганглия составляет в среднем 8.5 пг. Учитывая, что количество ДНК, как указывалось выше, равно 6-6.5 пг, на РНК приходится лишь 2-2.5 пг.
Содержание ионов натрия и хлора в глии выше, а калия и воды - такое же, как в нейронах (Koch et al., 1962).
Содержание АТФ в нейроглии в несколько раз выше (Hyden, 1962), а интенсивность дыхания - в 10-12 раз ниже, чем в нейроне (Korey a. Orchen, 1959).
Оценка активности окислительных ферментов в глии проводилась преимущественно методами качественной гистохимии; обзор этих данных (Schiffer, 1964) свидетельствует об их противоречивости: одни авторы считают, что глия весьма бедна окислительными ферментами, другие утверждают, что активность этих ферментов в глии - того же порядка, что и в нейроне. Трудность интерпретации этих данных усугубляется еще и тем, что, по-видимому, даже в пределах одного вида глии клетки, расположенные в разных отделах мозга и даже в разных слоях одного отдела, могут отличаться по активности окислительных ферментов (Kultas, 1965).
Немногочисленные количественные определения указывают на преобладание в глии по сравнению с нейроном активности АТФ-азы, цитохромоксидазы и сукциноксидазы (Hyden, 1960, 1962), α-глицерофосфатдегидрогеназы (Hess a. Pearse, 1961) и на не меньшую, чем в нейроне, активность альдолазы и щелочной фосфатазы (Lowry et al., 1954). В то же время активность таких ферментов, как глутаматдегидрогеназа, фосфоглюкоизомераза, глутаматаспартатаминотрасфераза в нейроглии ниже, чем в нейроне (Lowry et al., 1954).
Холинэстеразная активность в нервной ткани распределяется чаще всего таким образом, что ацетилхолинэстераза (или "истинная") холинэстераза находится в нейронах, а неспецифическая холинэстераза (или "псевдохолинэстераза") - в нейроглии (Gerebtzoff, 1959); однако эта закономерность справедлива не для всех видов животных (Friede a. Fleming, 1964).
Активность карбоангидразы (фермент, превращающий накапливающийся в тканях углекислый газ в угольную кислоту), поданным Джакобини (Giacobini, 1962), в нейроглии в 120 раз выше, чем в нейроне. Автор приписывает этому ферменту важную роль в минеральном обмене, предполагая, что образующийся в нейроне СО2 диффундирует в глию, где под действием этого фермента образуется Н2СО3; последняя диссоциирует на ионы, и анион НСО3- выходит в кровь в обмен на анион Сl-, вместе с которым из крови в глию попадает и Na+, а в обмен на последний в кровь и спинномозговую жидкость может выходить К+.
3. Биохимические изменения в нейроглии в ходе функциональной активности нейрона
Анализ биохимических характеристик глиальных клеток выявил определенную стабильность некоторых компонентов нейроглии в условиях значительного изменения функционального состояния нейрона.
Так, гипоксия, вызывающая компенсаторную активацию цитохромоксидазы и сукциноксидазы в нейроне, почти не влияет на активность этих ферментов в глии (Hyden, 1960). Дозы инсулина, вызывающие у морских свинок отчетливое снижение содержания гликогена в спинномозговых нейронах, не оказывали влияния на его уровень в глиальных клетках; после устранения же гипогликемии содержание гликогена в нейроглии снижалось (Gentschev, 1960).
Хотя уровень эндогенного дыхания нейроглии, по данным Хидена и его сотрудников (Hyden, 1964), в 7 раз выше по сравнению с уровнем в нейроне, добавление извне субстратов (глутамат, α-кетоглутарат, пируват + малат) резко повышало дыхание в нейронах и весьма слабо - в нейроглии.
Длительное вращение кроликов (по 25 мин. 2 раза в день в течение 7 дней) вызывало в вестибулярных нейронах повышение содержания белка и РНК и активности сукциноксидазы, в окружающих же глиальных клетках-сателлитах все изменения были противоположными (Hyden, 1962). Аналогичный эффект наблюдался при введении нейротропных веществ типа тофранила и его производных (Hyden, 1964).
По нашим данным, длительное раздражение верхнего шейного симпатического ганглия, привадившее к повышению содержания РНК и белка в цитоплазме его нейронов, вызывало снижение содержания нуклеиновых кислот в олигодендроглиоцитах ганглия (рис. 8). Активация обменных процессов в ганглии при помощи длительного введения малых доз адреналина (Певзнер, 1964) приводила к отчетливому повышению содержания нуклеиновых кислот и белка в нейроглии, тогда как в нейронах это повышение было гораздо слабее или вовсе отсутствовало (рис. 9).
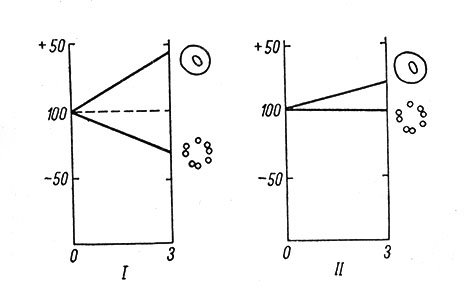
Рис. 8. Изменения в содержании нуклеиновых кислот и белка в нервных и глиальных клетках верхнего шейного симпатического ганглия кошки в результате 3-часового раздражения ганглия. По оси абсцисс - длительность раздражения, в час.; по оси ординат - изменения в содержании вещества, в %. 100% - содержание до раздражения. Справа от каждого графика условно изображены нейрон и глиальные клетки. I - нуклеиновые кислоты; II - белок
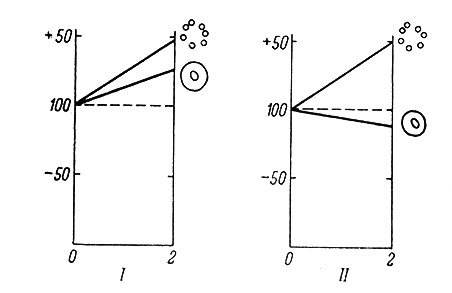
Рис. 9. Изменения в содержании нуклеиновых кислот и белка в нервных и глиальных клетках верхнего шейного симпатического ганглия кошки в результате ежедневного введения адреналина. По оси абсцисс - длительность введения адреналина, в неделях. Остальные обозначения те же, что на рис. 8
На основании собственных и литературных данных мы можем представить себе соотношение биохимических процессов в системе нейрон-нейроглия (на примере метаболизма белка и нуклеиновых кислот) в виде следующей схемы (рис. 10). В каждой из трех основных частей (отделов, compartments) системы нейрон-нейроглия, а именно в ядре, цитоплазме и окружающем поясе глиальных клеток - устанавливается характерный для состояния покоя определенный уровень сбалансированности между катаболитическими и анаболитическими процессами. Можно с уверенностью утверждать, что этот уровень значительно более стабилен в ядре нервной клетки, чем в ее цитоплазме; в отношении глиальных клеток этот вопрос еще требует дополнительного изучения. Состояние возбуждения стимулирует синтетический аппарат нейрона, который, однако, на более поздних стадиях возбуждения уже не может обеспечивать интенсивный синтез нуклеиновых кислот. Тогда, по всей вероятности, включаются дополнительные механизмы, локализованные в нейроглии; не исключено (Hyden, 1960), что нуклеиновые кислоты (может быть, частично и белки) непосредственно переходят из нейроглии в цитоплазму нейрона при помощи пиноцитоза. В дальнейшем и эти дополнительные механизмы истощаются, а уровень РНК и белка в нейроне быстро снижается; это несомненно соответствует переходу нервных клеток в состояние перевозбуждения, истощения, утомления и т. п. Отсюда логично предположить, что трофические влияния, повышающие работоспособность нейронов, действуют именно на метаболизм нейроглии. Вероятно, и репаративные процессы в утомленных нейронах также начинаются с восстановления анаболизма в глиальных клетках, после чего восстановление происходит и в нейроне, и в результате система нейрон-нейроглия приобретает исходный вид, характерный для состояния покоя.
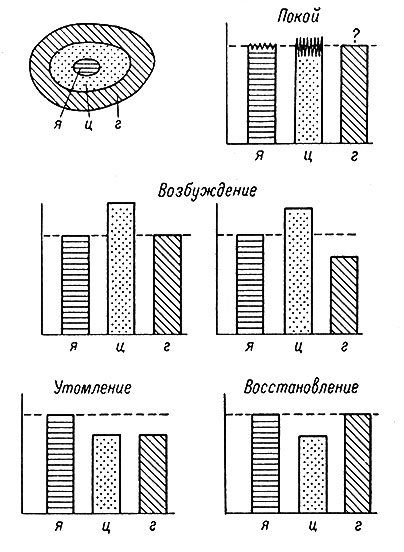
Рис. 10. Метаболизм белка и нуклеиновых кислот в системе нейрон-нейроглия при различных функциональных состояниях нервной системы. Высота столбика - общее содержание белка и нуклеиновых кислот в соответствующей структуре, я - ядро; ц - цитоплазма; г - глия
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'