III. Химический состав нейрона
1. Содержание плотных веществ (сухой вес)
Сочетание разных методов определения показало, что у самых различных по форме, размерам, локализации нейронов концентрация плотных веществ весьма постоянна и, как видно из табл. 3, колеблется в узких пределах 0.15-0.25 г/см3 (или пг/мк3).
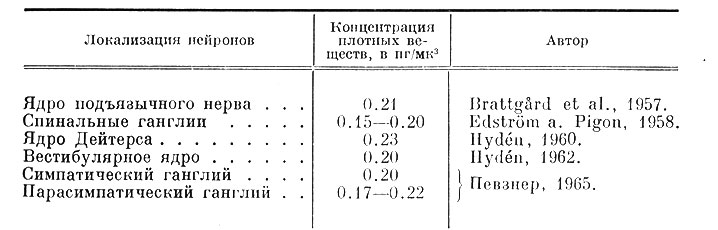
Таблица 3. Концентрация плотных веществ (сухой вес) различных нейронов
В условиях применяемых в настоящее время микрохимических и цитоинтерферометрических определений величина концентрации плотных веществ в препарате более чем на 90% обусловлена содержанием клеточного белка. Поэтому приведенные в табл. 3 данные свидетельствуют о постоянной концентрации белка в нейронах разных видов. Отсюда следует, что общее количество белка на клетку зависит в основном от размеров нейронов: в крупных нейронах белка больше, чем в мелких.
2. Содержание дезоксирибонуклеиновой кислоты (ДНК)
Содержание ДНК на одну клетку, напротив, характеризуется значительным постоянством вне зависимости от размеров клеток. Это важное положение было впервые сформулировано Буавеном и сотрудниками (Boivin et al., 1948) на основе биохимического определения ДНК в гомогенатах разных органов с подсчетом числа клеток и последующим расчетом количества ДНК на одну клетку. Дальнейшее детальное, как биохимическое, так и цитофотометрическое исследование этого вопроса (Ven-drely a. Vendrely, 1956) подтвердило, что отношение количества ДНК в соматических клетках к ее количеству в сперматидах соответствует степени полиплоидии: в диплоидных клетках отношение вдвое выше, в тетраплоидных - в 4 раза выше и т. д.
На рис. 2 представлена гистограмма распределения ганглиозных клеток сетчатки лягушки по содержанию в них ядерной ДНК (Бродский, 1959). Отчетливо видно, что все клетки группируются вокруг трех средних величин содержания ДНК со значениями 2, 4 и 8 n, где n - количество ДНК в гаплоидных ядрах того же животного (2n = 5.5 пг).
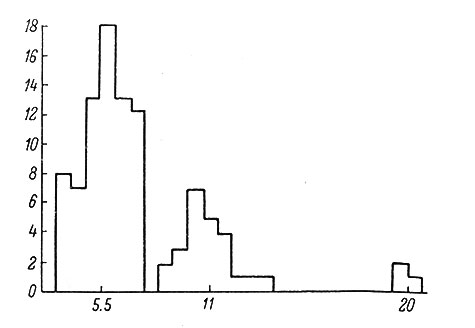
Рис. 2. Гистограмма распределения ганглиозных клеток сетчатки лягушки по содержанию в них ядерной ДНК. (Бродский, 1959). По оси абсцисс - количество ДНК на одну клетку, в пг (1 пг = 10-12 г); по оси ординат - соответствующее данному количеству ДНК число клеток, в % от их общего количества
Для нейронов коры головного мозга кошки - клеток с диплоидным набором хромосом - получена величина содержания ДНК порядка 7-8 пг (Певзнер, 1960а).
Одним из кардинальных положений теории постоянства ДНК является то, что в интеркинетических ядрах количество ДНК, - носителя генетической информации клетки, - не меняется под влиянием различных факторов, изменяющих функциональное состояние клетки (при условии, конечно, что эти факторы не являются мутагенными или особо губительными). Действительно, и в отношении нервных клеток было показано, что как адекватная стимуляция (освещение сетчатки прерывистым светом разной длительности), так и стрессорные воздействия (гипоксия коры головного мозга) не влияют на содержание ДНК в соответствующих нейронах (Бродский, 1959, 1960; Певзнер, 1959, 1960б).
В органах с активным делением клеток (кишечник, кожа, печень и др.) периодически происходит удвоение количества ДНК, предшествующее митозу в клетке. В нервной системе взрослого организма, как принято считать, деления нейронов не происходит. Однако существует другой путь увеличения содержания ДНК в клеточном ядре: речь идет о явлении полиплоидии. Как показано недавно В. Я. Бродским (1964), отдельные диплоидные нервные клетки способны при определенных условиях образовывать тетра- и даже октаплоидные ядра, вследствие чего количество ДНК в них становится соответственно в 2 или 4 раза выше. По-видимому, такая полиплоидия носит адаптационный, компенсаторный характер, являясь фактически формой физиологической регенерации структурных единиц нервной ткани.
3. Содержание рибонуклеиновой кислоты (РНК)
Концентрация РНК в нейронах разных типов весьма постоянна, вследствие чего общее содержание РНК на одну клетку зависит от исходных размеров клеток. Как видно из табл. 4, крупные нейроны содержат столь большое количество РНК, что с ними могут сравниться лишь некоторые секреторные клетки, например, экзокринные клетки поджелудочной железы.

Таблица 4. Содержание РНК на одну клетку для разных видов нейронов
В отличие от содержания ДНК, количество РНК в нейронах претерпевает значительные и весьма быстро протекающие изменения в зависимости от функционального состояния нервной системы. При этом четко выявляется определенная закономерность: возбуждение нейрона сопровождается усиленным синтезом РНК (табл. 5), тогда как при торможении, утомлении, истощении в нервных клетках распад РНК начинает преобладать над синтезом, в результате чего содержание РНК в нейроне быстро снижается (табл. 6). Эти изменения весьма однотипны, поэтому трудно говорить об их специфичности. Однако в ряде случаев удается установить количественную связь выявленных изменений с функциональными особенностями нейронов. Так, из двух типов биполярных клеток сетчатки только один тип нейронов, по электрофизиологическим данным, реагировал на прерывистое освещение сетчатки, и именно в нейронах этого типа выявлено повышение содержания РНК, тогда как в весьма близких по своему строению нейронах второго типа не было изменения биопотенциалов в ответ на освещение сетчатки и не было никаких сдвигов в содержании РНК (Утина, 1960). Аналогичное явление (изменения метаболизма РНК только в тех нейронах, где в ответ на стимуляцию зарегистрировано изменение биопотенциалов) выявлено Грампом и Эдстрёмом (Grampp a. Edstrom, 1963) при исследовании рецептора растяжения омара.

Таблица 5. Влияние возбуждения нейронов на содержание в них РНК
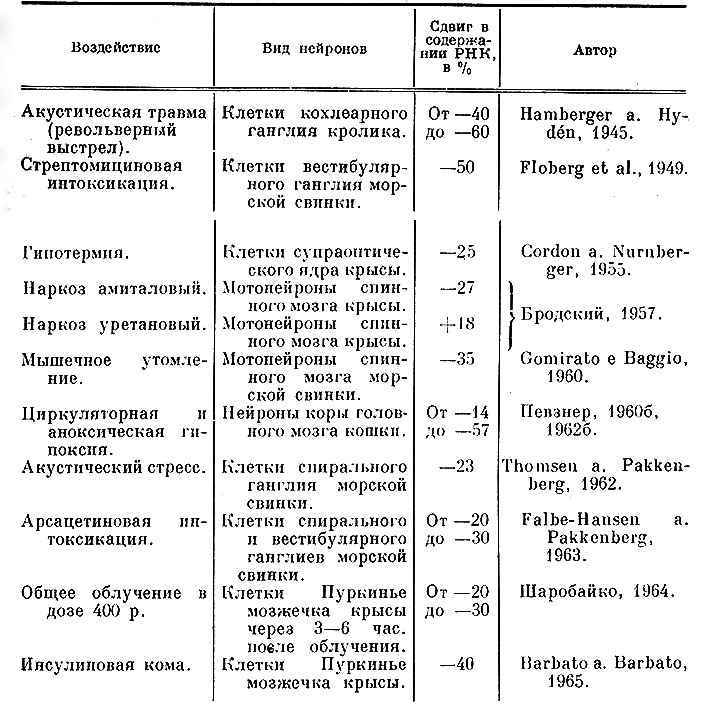
Таблица 6. Влияние утомления и стрессорных агентов на содержание РНК в нейронах
Точно так же снижение содержания цитоплазматической РНК в нейронах коры головного мозга кошек под влиянием разных видов гипоксии мозга оказалось неодинаковым в зависимости от функциональных зон коры (рис. 3): отчетливым в двигательной и особенно в зрительной зоне и весьма незначительным в слуховой зоне коры (Певзнер, 1962б).
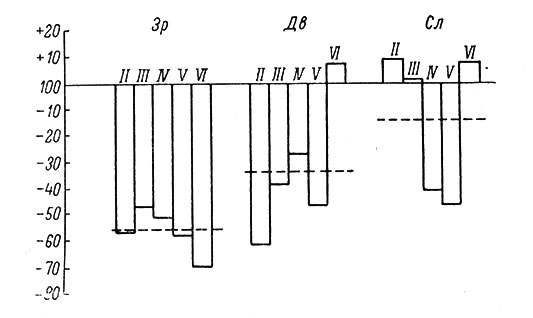
Рис. 3. Изменение содержания цитоплазматической РНК в разных клеточных слоях коры головного мозга кошки после циркуляторной гипоксии. Римские цифры по оси абсцисс - слои коры: Зр - зрительная зона коры, Дв - двигательная, Сл - слуховая; по оси ординат - изменения в содержании РНК после гипоксии, в %: 100% - норма для соответствующих слоев коры; прерывистая линия - величина среднего изменения для всей зоны
Данные, приведенные в табл. 5 и 6, получены при исследовании либо суммарной РНК всего нейрона, либо чаще цитоплазматической РНК. Цитохимический анализ не дает пока возможности раздельного определения таких фракций РНК, как растворимая, рибосомальная и информационная РНК. По-видимому, общая цитоплазматическая РНК, выявляемая цитохимически, это в основном рибосомальная РНК. Правда, А. Л. Шабадашу (1957) при помощи разработанной им оригинальной методики фиксации и окраски нервной ткани удалось различить в нейронах и митохондриальную РНК; по данным этого автора, митохондриальная РНК, несмотря на сравнительно низкое содержание ее в цитоплазме нейрона, является функционально более лабильной, чем РНК тигроида, осуществляющая, как полагает А. Л. Шабадаш, скорее резервную или пластическую роль. Другими авторами цитохимический анализ митохондриальной РНК не проводился.
Большой интерес представляет ядерная РНК, составляющая около 10% всей РНК нейрона. Она обновляется с большей скоростью, чем цитоплазматическая; есть даже представление о том, что ядерная РНК является предшественником цитоплазматической (Хесин, 1960). Как видно из рис. 4, под влиянием прерывистого освещения сетчатки изменения в содержании ядерной РНК наступают раньше и протекают более многообразно по сравнению с цитоплазматической РНК (Бродский, 1960).
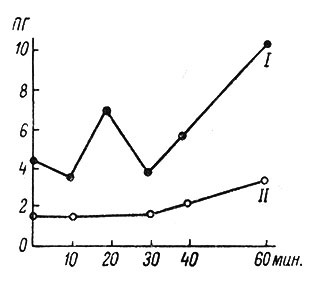
Рис. 4. Влияние прерывистого освещения на содержание ядерной и цитоплазматической РНК в ганглиозных нейронах сетчатки лягушки. (Бродский, 1960). По оси абсцисс - длительность освещения сетчатки; по оси ординат - содержание РНК на одну клетку. I - ядерная РНК; II - цитоплазматическая РНК
За последние годы благодаря применению особо чувствительных методов микрохимического анализа выявлено присутствие РНК и в аксонах нейронов. Хотя концентрация РНК в аксоплазме на порядок ниже, чем в цитоплазме, общее количество РНК в длинных аксонах может превышать количество цитоплазматической РНК в несколько раз (Edstrom, 1964).
4. Белковый синтез в нейроне
Метаболизм белка в нервных клетках характеризуется такими же особенностями, что и метаболизм РНК: высоким содержанием белка и выраженной функциональной лабильностью его. При этом как биохимические, так и цитохимические исследования показывают (см. обзоры: Палладии, 1959; Hyden, 1960), что при возбуждении нервных клеток в них происходит усиленный белковый синтез, при наступлении же перевозбуждения, истощения, утомления нервной системы начинает преобладать распад белковых молекул, в результате чего содержание белка снижается.
Локализация белкового синтеза внутри нейрона, по мнению В. Я. Бродского, может быть ядерной или цитоплазматической в зависимости от филогенетических и функциональных особенностей клеток. Так, ганглиозные нейроны сетчатки лягушки реагировали на прерывистое освещение прежде всего повышением содержания белка в ядре (Бродский, 1961).
Напротив, в нейронах верхнего шейного симпатического ганглия кошки (рис. 5) длительное электрическое раздражение преганглионарного ствола вызывало повышение содержания белка (а также РНК) только в цитоплазме, тогда как в ядре имело место недостоверное снижение содержания белка (Певзнер, 1965). В цитоплазме нуклеиновые кислоты представлены одной лишь РНК, отличающейся, как указывалось выше, высокой функциональной лабильностью, в ядре же основную массу нуклеиновых кислот составляет ДНК, уровень которой в нейронах характеризуется значительным постоянством (Певзнер, 1963). Таким образом, в данном случае мы имеем дело, по-видимому, с примером внутриклеточной компартментализации белков и нуклеиновых кислот симпатических нейронов на ядерный "котел", биологическая роль которого определяется его стабильностью, и цитоплазматический "котел", в котором могут происходить значительные сдвиги в соотношении процессов синтеза и распада при изменении функционального состояния нейронов.
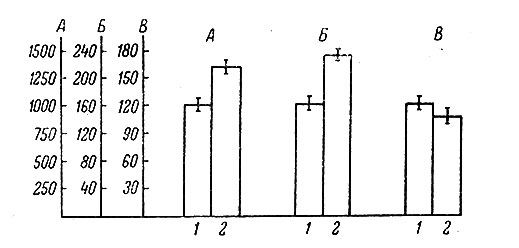
Рис. 5. Влияние раздражения преганглионарного ствола на содержание белка и РНК в нейронах верхнего шейного симпатического ганглия кошки. По оси ординат - содержание белка в цитоплазме (А), содержание РНК в цитоплазме (Б), содержание белка в ядре (В), в пг. 1 - контроль; 2 - 3-часовое раздражение преганглионарного ствола. Вертикальные черточки - ошибки средней арифметической
Параллелизм в направленности изменений в метаболизме нуклеиновых кислот и белка в нейронах ставит вопрос о том, какова роль повышения содержания РНК в цитоплазме возбужденного нейрона: определяется ли это повышение целиком участием РНК в усиленном синтезе белка, сопровождающем возбуждение, или же повышенное накопление РНК в этих условиях имеет и иной биологический смысл? В настоящее время ответить на этот вопрос не представляется возможным, но, по-видимому, ролью РНК в белковом синтезе не исчерпывается ее участие в интенсификации обмена в нейроне при активации его функции.
Приведенные на рис. 4 данные В. Я. Бродского (1960) свидетельствуют о том, что самые ранние изменения содержания РНК в ядре ганглиозных нейронов сетчатки лягушки наступают примерно через 10 мин. после перехода от темноты к свету. Этот период значительно длительнее, чем время физиологической адаптации глаза к свету. Отсюда автор делает вывод (с которым, по всей видимости, надо согласиться), что обмен нуклеиновых кислот в нервных клетках отражает не первичные биохимические процессы, непосредственно отвечающие за изменение физиологической активности нейрона, а скорее какие-то вторичные реакции, носящие характер компенсаторных (Бродский, 1961).
Синтез белка в теле нервной клетки компенсирует не только распад белка на месте; часть белков мигрирует из тела нейрона по аксону (Weiss, 1961; Droz a. Leblond, 1963; Lajtha, 1964). Скорость такой миграции (в опытах с регенерацией поврежденного нерва) составляет в среднем 1-3 мм в сутки. Механизм этой миграции пока не ясен; по-видимому, с явлением миграции белка как-то связаны те активные биохимические процессы, которые происходят в синаптической области. Не исключено, что только часть белка, достигающего синапсов, синтезируется в теле нейрона, синтез другой же части, возможно, осуществляется шванновскими клетками.
Хотя механизмы взаимосвязи специфической активности нейрона с метаболизмом РНК в нем остаются неясными, сам факт такой взаимосвязи сомнений не вызывает. При этом, по-видимому, не только нормальный обмен РНК является условием функционирования нейрона, но и наоборот - активное состояние нейрона необходимо для обеспечения нормального хода процессов метаболизма РНК в нейроне. Это особенно четко показано Братгёрдом (Brattgard, 1952). Автор проследил ход нормального повышения содержания РНК в цитоплазме нейронов сетчатки кроликов от рождения до 10-недельного возраста. За этот период содержание цитоплазматической РНК возрастало более чем вдвое. Если же крольчат периодически помещали в темноту, нарастание содержания РНК шло гораздо медленнее, а при постоянном пребывании новорожденных животных в полной темноте увеличения количества РНК в клетках сетчатки с ростом животных не происходило вовсе. Таким образом, адекватная физиологическая стимуляция оказалась необходимым условием нормального синтеза РНК. Вероятно, в данном случае правомочно говорить о трофическом влиянии нервной активности.
Как указывалось выше, самые разнообразные агенты, вызывающие возбуждение нервных клеток, приводят к однотипному эффекту - нарастанию содержания РНК в нейронах. Точно так же самые разнообразные тормозные, утомляющие влияния на нервные клетки вызывают одинаковый результат - большее или меньшее снижение количества РНК. Это свидетельствует, по-видимому, о неспецифичности выявляемых изменений в метаболизме нейрональной РНК.
Однако не исключено, что применяемый при этих исследованиях метод определения суммарного содержания РНК (или даже содержания РНК в отдельных частях нейрона) недостаточно адекватен. Изучаемые сдвиги в количестве РНК являются отражением тонких качественных изменений в молекулах РНК, и, видимо, не всегда эти качественные изменения сопровождаются в той же мере и количественными сдвигами. Так, Грамп и Эдстрём (Grampp a. Edstrom, 1963) при 6-часовом раздражении нейронов рецептора растяжения омара выявили изменение нуклеотидного состава РНК (повышение отношения аденина к урацилу), тогда как общее содержание РНК в возбужденных нейронах оставалось неизменным.
С целью изучения роли РНК в более специфических реакциях нервных клеток (в частности, в таком явлении, как память) Хиден и Эгихази (Hyden a. Egyhazi, 1962) провели следующий эксперимент. Голодных крыс помещали перед пищей, уложенной на узкую платформу, поднятую на высоту 75 см. Чтобы достать пищу, крысе приходилось карабкаться к этой платформе по проволоке длиной 90 см и толщиной 1.5 см. Схватив кусок пищи, крыса сбегала вниз, съедала пищу и карабкалась снова. За время опыта (45 мин.) животные успевали взобраться за пищей 3-5 раз. Однако с каждым днем скорость их влезания по проволоке увеличивалась, и через 4 дня они успевали проделать тот же путь до 20 раз за время опыта. Анализ нуклеотидного состава ядерной РНК в нейронах ядра Дейтерса выявил отчетливые изменения после 4 дней обучения, тогда как в цитоплазматической РНК никаких сдвигов нуклеотидного состава не было отмечено, повышалось лишь ее количество. Чтобы убедиться в том, что сдвиги нуклеотидного состава ядерной РНК этих нейронов не связаны с неспецифическим раздражением вестибулярного аппарата, авторы подвергали другую группу крыс ежедневному пассивному вращению 2 раза в день по 25 мин. со скоростью 30 об./мин. Через 4 дня у этих животных также было отмечено некоторое увеличение содержания цитоплазматической РНК, нуклеотидный же состав ни ядерной, ни цитоплазматической РНК не изменился (табл. 7). Авторы полагают, что выявленные ими изменения в составе ядерной РНК при обучении отражают явление запоминания информации, поступающей в ходе этого специального эксперимента.
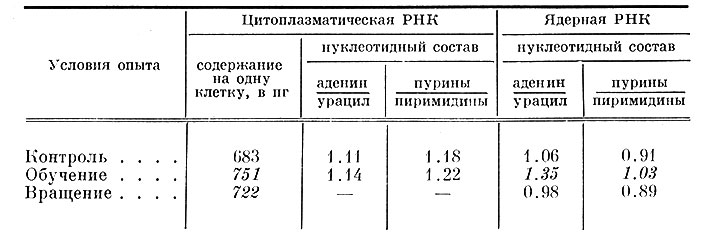
Таблица 7. Содержание и нуклеотидный состав цитоплазматической и ядерной РНК в нейронах ядра Дейтерса крыс при обучении (Hyden a. Egyhazi, 1962б). Примечание. Курсивом даны величины, отличие которых от соответствующих контрольных величин статистически достоверно (Р ≤ 0.01)
На основании приведенных выше, а также некоторых других данных Хиден (Hyden, 1960) предлагает свою гипотезу памяти (рис. 6). Первым этапом считается поступление в нервную клетку информации, закодированной, например, в виде частотной модуляции, вследствие чего меняется состав ионов, а это вызывает и вхождение в полинуклеотидную цепочку РНК нового нуклеотида. Вторым этапом автор считает синтез на этой измененной РНК как на матрице нового, соответственно измененного белка. Белок соединяется с активатором, который может иметь комплементарное строение к строению данного белка, в результате образуется комплекс, который затем расщепляется, высвобождая низкомолекулярные продукты, играющие роль медиаторов. Если поток специфической информации надолго прекращается, то в результате естественного процесса обновления молекул состав РНК возвращается к первоначальному, следовательно синтез специфического белка отсутствует и поступление сигналов в форме медиатора прекращается.
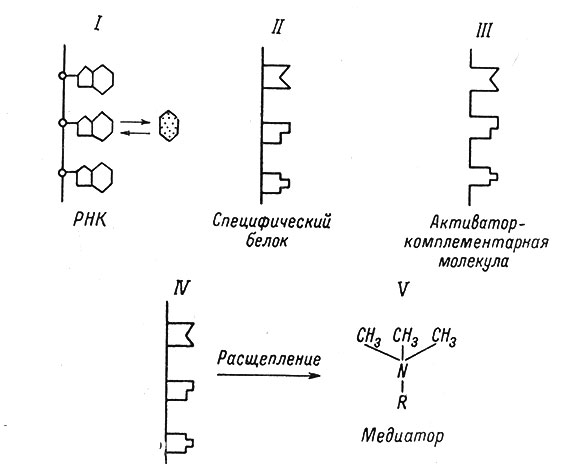
Рис. 6. Схема участия РНК в механизме памяти. (Hyden, 1960). I-V - последовательные этапы химических изменений в нервной клетке, связанных с процессом запоминания и воспроизведения информации
Несмотря на ценность самой попытки предложить гипотезу, объединяющую функцию нервных клеток и их метаболизм, выдвинутая гипотеза, как легко видеть, является сугубо умозрительной. По сути дела ни один из предложенных этапов (кроме первого, да и то весьма фрагментарно) не обоснован экспериментально. Выдвинутые другими авторами гипотезы о связи памяти с метаболизмом ДНК в еще большей степени базируются на рассуждениях весьма спекулятивного характера. Рассмотрение этих гипотез и подробную литературу можно найти у Гэйто (Gaito, 1963).
5. Углеводы и липиды
Для анализа этих компонентов нервных клеток пока не существует надежных количественных цитохимических методик, поэтому судить об их функциональных изменениях можно лишь в самых общих чертах.
Окраска нервных клеток на гликоген йодной кислотой-реактивом Шиффа после прижизненной фиксации специальным составом позволила создателю этого метода А. Л. Шабадашу показать, что гликоген в нейронах представляет собой весьма лабильное соединение, быстро распадающееся при целом ряде воздействий на нервную систему, в том числе и в ходе самой процедуры забивания животного и извлечения мозга (Шабадаш, 1949). Автор выявил 3 типа нейронов, которые у большинства лабораторных животных (собаки, кошки, кролики, морские свинки и др.) существенно отличаются по содержанию гликогена. Так, в мотонейронах спинного мозга и чувствительных клетках спинальных ганглиев содержание гликогена весьма высокое и постоянное; в вегетативных нейронах наблюдались крайне лабильные, непостоянные скопления гликогена, тогда как в нейронах задних рогов спинного мозга, клетках всех слоев коры головного мозга и мозжечка не удалось выявить присутствия гликогена (во всяком случае, пользуясь данной методикой). Интересно, что во всех типах нейронов, где обнаружен гликоген, его локализация в точности соответствовала глыбкам тигроида (т. е. скоплениям рибонуклеопротеидов).
Содержание ганглиозидов в гомогенатах различных отделов нервной системы, по данным Лоудена и Уолфа (Lowden a. Wolff, 1964), оказалось высоким в участках, богатых нейронами (кора головного мозга, кора мозжечка) и весьма низкой (или равной нулю) в тех отделах нервной системы, где нервные клетки находились в меньшем количестве (спинной мозг, подкорка) или вовсе отсутствовали (мозолистое тело, периферические нервы). Отсюда авторы делают вывод, что ганглиозиды являются специфическими липидами, локализованными только в нейронах.
Зависимость содержания липидов в нейронах от функционального состояния нервной системы почти не исследовалась. В обзоре данных по функциональным сдвигам в составе нейрона Хиден (Hyden, 1960) упоминает, что при изменениях функционального состояния нейронов ему и его сотрудникам удавалось зарегистрировать наряду со сдвигами метаболизма белков и нуклеиновых кислот также изменения и в обмене липидов. Д. А. Четвериков и И. Н. Улыбина нашли, что в условиях гипоксии происходят не столько сдвиги в количестве липидов в нервных клетках разной локализации, сколько изменения характера распределения липидных скоплений в цитоплазме этих нейронов (Ghetverikov a. Ulibina, 1964).
Ряд гистохимических данных свидетельствует о соединении липидов в нервных клетках в единый комплекс с цитоплазматической РНК (Cisotti, 1959; Preto, Parvis e Bosisio, 1960; Perboll, 1962, и др.). Более детальное исследование этого вопроса должно выявить, какова чувствительность липидного компонента этого комплекса к изменению функционального состояния нервной системы. Интересно, что липиды, как и белки, также способны к миграции из тела клетки вдоль по аксону, причем скорость этой миграции в разных аксонах неодинакова: по данным Миани (Miani, 1962, 1963), по аксону подъязычного нерва фосфолипиды мигрировали со скоростью 39-41 мм/сутки, а по аксону блуждающего нерва - со скоростью 72 мм/сутки.
6. Ферменты
Анализ активности ферментов в теле нейрона представлял бы несомненную научную ценность ввиду того, что все описанные выше функциональные сдвиги в обмене различных компонентов нейрона в конечном итоге определяются соотношением активностей ферментов и ферментных систем.
Однако в отношении ферментов нервных клеток известно очень мало. Обширная литература по гистохимии ферментов нервной ткани требует весьма критического отношения, так как при исследованиях такого рода возможность артефактов неизмеримо выше, чем при гистохимическом определении неферментных компонентов гистологического среза. Ферменты весьма чувствительны к воздействию фиксаторов и других реактивов, применяемых в ходе гистологической обработки ткани. При инкубации того или иного субстрата с исследуемой тканью этот субстрат может подвергаться воздействию и других ферментных систем, присутствующих в ткани. Для непосредственного контакта добавленного извне субстрата с внутриклеточным ферментом субстрат должен проникнуть через ряд барьеров и мембран, состояние которых может меняться, имитируя тем самым изменения активности фермента. Поэтому основные, весьма малочисленные данные об активности ферментов в нервных клетках (табл. 8) получены методами микрохимического анализа с выделением очень малых навесок нервной ткани. Как видно из табл. 8, в нервной клетке представлен ряд основных ферментов окислительного обмена, обмена аминокислот и т. д.

Таблица 8. Активность ферментов в теле нейрона
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'