Занятие 29. Кислородное голодание
Цель занятия
Показать в экспериментах на животных основные типы кислородного голодания и значение некоторых компенсаторно-приспособительных механизмов в устойчивости организма к кислородному голоданию.
Подготовка к занятию
Студенты готовятся к данному занятию в объеме следующих вопросов.
1. Понятие о кислородном голодании как энергетическом дефиците тканей организма, в первую очередь головного мозга.
2. Патогенетические механизмы различных типов кислородного голодания. Их классификация (по И. Р. Петрову): экзогенный дыхательный, циркуляторный, кровяной, тканевой и смешанный типы кислородного голодания.
3. Компенсаторные реакции и нарушения физиологических функций при кислородном голодании.
Техническое оснащение и подготовка занятия*
* (Из расчета на группу или на подгруппу из 4-5 студентов.)

Примечание. Для опытов 1, А и 1, Б двух мышей подготавливают заранее, помещая их в течение 3 дней до опыта на некоторое время в сосуд, содержащий гипоксические смеси: в первый день - 8% кислорода, во второй - 6%, в третий - 5% кислорода. Проводят в течение дня несколько (3-5) экспозиций, следя за тем, чтобы у животных не возникало состояние тяжелой гипоксии.
Наименование опытов и методика их проведения
Опыт 1. Экзогенный тип кислородного голодания.
А. Коническую колбу, снабженную пробкой с отводами, заполняют чистым азотом и помещают в нее 2 мышей: одну интактную и одну предварительно подвергавшуюся действию гипоксических смесей. Колбу быстро закрывают пробкой и наблюдают картину кислородного голодания до гибели животных, регистрируя развивающиеся симптомы и сроки гибели. Одно из погибших животных (ранее интактное) вскрывают и берут кровь для спектроскопического исследования (см. опыты 3, А и 3, Б и приложение 2).
Б. Коническую колбу (ту же, что в опыте 1, А) заполняют газовой смесью, содержащей 4% кислорода и 96% азота. Опыт проводят аналогично предыдущему.
Результаты опытов 1, А и 1, Б сопоставляют и делают соответствующие выводы о значении компенсаторных механизмов при различных степенях кислородного голодания.
Опыт 2. Дыхательный тип кислородного голодания.
А. Смертельная асфиксия, вызванная зажатием трахеи.
Белую крысу, находящуюся в состоянии умеренного наркоза (0,75 мл 10% раствора уретана на 100 г веса), фиксируют на вивисекционном столике спиной вниз, производят срединный разрез кожи на шее, обнажают трахею и подводят под нее толстую лигатуру. При помощи пневматической манжетки и капсулы Марея или серфинки и рычажка Энгельмана регистрируют на кимографе дыхательные экскурсии грудной клетки. Одновременно производят запись одного из стандартных отведений электрокардиограммы. Затем посредством лигатуры наглухо пережимают трахею, вызывая у животного смертельную асфиксию. Наблюдают последовательность стадий асфиксии, непрерывно регистрируя дыхательные движения и несколько раз возобновляя запись электрокардиограммы. Погибшее животное вскрывают и наблюдают признаки смерти от асфиксии.
Б. Острая асфиксия, вызванная параличом дыхательных мышц. Белую крысу фиксируют спиной вниз, налаживают запись дыхательных движений и электрокардиограммы. Отпрепаровывают бедренную вену и вводят в нее тонкой иглой 0,01% раствор дитилина (мышечного релаксанта кратковременного действия) из расчета 1 мл на 100 г веса. Спустя 11/2-2 минуты после остановки дыхания, при еще продолжающейся сердечной деятельности, животному производят искусственное дыхание.
Для контроля за состоянием животного (работа сердца, возможность появления самостоятельного дыхания) искусственное дыхание периодически прекращают на несколько секунд, записывая в это время электрокардиограмму. Обращают внимание на тесную функциональную связь между дыханием и сердечной деятельностью.
Обычно в пределах 10 минут происходит восстановление самостоятельного дыхания. Искусственное дыхание прекращают полностью лишь в том случае, если появившиеся дыхательные движения становятся устойчивыми. Кожный разрез на бедре зашивают, крысу отвязывают. Полное восстановление тонуса мускулатуры тела происходит в этом опыте спустя 10-20 минут от момента инъекции дитилина.
Опыт 3. Кровяной тип кислородного голодания.
А. Отравление метгемоглобинообразователями. Мыши вводят подкожно 1% раствор азотистокислого натрия из расчета 0,07-0,1 мл на 1 г веса, после чего животное помещают под воронку для наблюдения за развивающейся картиной кислородного голодания.
Вскрытие и исследование крови погибшей мыши производят согласно приложению 1. Сопоставляют окраску крови и внутренних органов, а также результаты спектроскопического анализа крови данной мыши с таковыми у мышей, погибших в опытах 1, А и 3, Б.
Б. Отравление окисью углерода. Мышь помещают в банку или под воронку. С помощью резинового шланга, надетого на кран газовой сети, в банку (под воронку) впускают бытовой светильный газ, содержащий окись углерода. Так как постепенное, в течение 5-10 минут, отравление животных дает более выраженные изменения со стороны крови, создавая характерную картину на вскрытии, газ впускают малыми порциями (открытие крана на 2-3 секунды несколько раз в минуту). Наблюдают внешние симптомы кислородного голодания. Погибшую мышь вскрывают и берут кровь для визуального и спектроскопического исследования на наличие карбоксигемоглобина (см. приложение 2).
Опыт 4. Сердечно-сосудистый тип кислородного голодания. Белую крысу, находящуюся в состоянии умеренного наркоза (0,75 мл 10% раствора уретана на 100 г веса), фиксируют спиной вниз, отпрепаровывают бедренную артерию и налаживают регистрацию дыхательных движений и запись электрокардиограммы. Затем артерию перерезают и наблюдают за симптомами, характеризующими нарастающую гипоксию циркуляторного происхождения.
Приложение 1. Искусственное дыхание у крыс
Искусственное дыхание у крыс проводят с помощью простого прибора, изображенного на рис. 40. Он состоит из резиновой груши с впускным и выпускным клапанами (используют грушу от тонометра или аппарата Рива-Роччи) и системы трубок. Один отросток выпускного клапана груши перекрывают отрезком резиновой трубочки с вставленной в него стеклянной пробкой. Ко второму отростку присоединяют с помощью отрезка резиновой трубочки и переходной стеклянной канюли тонкую трубку длиной 10-15 см (можно использовать ниппельную резину). В свободный конец этой трубки вставляют отрезок еще более тонкой трубки длиной 2 см из упругого, но эластичного материала (например, хлорвиниловая изоляционная трубка или отрезок мочеточникового катетера). Этот отрезок служит для введения в одну из ноздрей крысы. Свободный конец его имеет косой разрез, а непосредственно перед введением его слегка смазывают вазелином. Это облегчает введение трубки в узкий носовой ход крысы на глубину 1-1,5 см.
Искусственное дыхание у крысы проводят путем нагнетания воздуха в легкие через одну из ноздрей (см. рис. 40). С этой целью ритмично, с частотой 50-70 раз в минуту, сжимают грушу рукой. Сила сжатий должна быть такой, чтобы экскурсии грудной клетки по своей величине были приблизительно одинаковы с естественным дыханием. Выдох происходит пассивно, за счет эластичности легких и грудной клетки.
Приложение 2. Техника проведения спектроскопического анализа
Пастеровской пипеткой во вскрытую грудную полость животного вводят 2 капли 7% раствора лимоннокислого натрия. Затем 2 капли нитратной крови из грудной полости вносят в пробирку, добавляют 5 мл дистиллированной воды и производят спектроскопию. Спектр оксигемоглобина содержит 2 четкие полосы поглощения в желто-зеленой части.
Спектр карбоксигемоглобина так похож на спектр оксигемоглобина, что необходима специальная реакция для их отличия. Такой реакцией служит прибавление восстановителя: 5 капель 0,5% раствора фенилгидразина. Если карбоксигемоглобина нет, то 2 полосы немедленно исчезают и заменяются сплошной широкой полосой восстановленного гемоглобина, расположенной в той же части спектра. При наличии карбоксигемоглобина полосы остаются на своих местах; иногда между ними появляется тень вследствие перехода примеси оксигемоглобина в восстановленный гемоглобин.
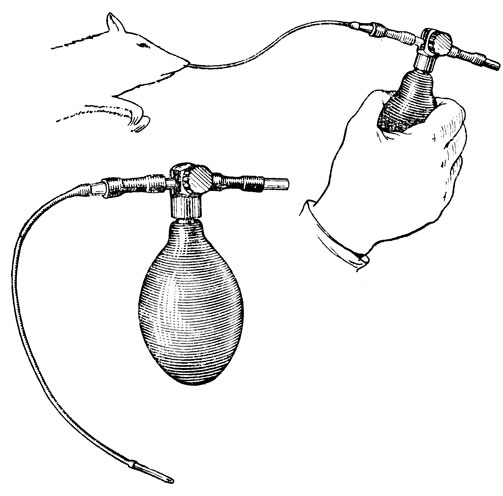
Рис. 40. Прибор для искусственного дыхания у крыс
Метгемоглобин определяется по наличию полосы поглощения в красной части спектра, но при небольшой концентрации метгемоглобина в крови эта полоса бывает нечетко выражена. В таком случае рекомендуется использовать дополнительную реакцию с фтористым натрием. При добавлении в пробирку с разведенной кровью 5 капель 4% раствора фтористого натрия образуется фторметгемоглобин, обладающий характерным спектром: хорошо видимая полоса поглощения в оранжевой зоне. Отсутствие этой полосы свидетельствует об отрицательном результате анализа.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'