Патология системы крови
Занятие 20. Анемии
Цель занятия
Рассмотреть основные сдвиги в периферической крови при экспериментальных гемолитической (фенилгидразиновой) и постгеморрагической анемиях у кроликов.
Подготовка к занятию
Студенты готовятся к данному занятию в объеме следующих вопросов.
1. Представление о нормобластическом и мегалобластическом типах кровотворения.
2. Понятие об анемиях, их классификация: а) по цветному показателю; б) по степени и качеству регенерации красных кровяных элементов; в) по величине эритроцитов; г) по типу эритропоэза.
3. Классификация анемий по важнейшим этиологическим и патогенетическим показателям: а) пернициозная анемия, ее этиология и патогенез; картина периферической крови; б) гемолитическая и постгеморрагическая анемии; наблюдающиеся при них качественные и количественные изменения эритроцитов, функциональная характеристика костного мозга.
4. Техника подсчета эритроцитов, определение гемоглобина, вычисление цветного показателя, изготовление и окраска мазка крови, прижизненная окраска ретикулоцитов и их подсчет. Оценка качественных изменений эритроцитов в окрашенном мазке.
Техническое оснащение занятия*
* (На группу в 12 человек.)


На каждого студента
В начале занятия студенты знакомятся с характерными особенностями гематологической картины при различных анемических состояниях по цветным таблицам. Находят в мазках, выставленных заранее под микроскопом, наиболее типичные для анемии клетки крови и зарисовывают их в тетради.
Наименование опытов и методика их проведения
Опыт 1. Экспериментальная гемолитическая анемия у кролика. За 3-4 дня до занятия в течение 2 дней под кожу спины кролика вводят 3% раствор солянокислого фенилгидразина из расчета 0,5 мл на 1 кг веса, в результате чего к моменту занятия у кролика развивается гемолитическая анемия. Студенты определяют в крови, взятой из краевых вен ушей подопытного и контрольного кроликов, количество эритроцитов в 1 мм3, содержание гемоглобина; вычисляют цветной показатель; изготовляют прижизненно окрашенные мазки, подсчитывают количество ретикулоцитов на 1000 эритроцитов; красят фиксированные мазки и зарисовывают характерные картины крови.
Опыт 2. Экспериментальная постгеморрагическая анемия у кролика. За месяц до занятия у кролика производят повторные (10-15 раз) кровопускания, каждый раз выпуская по 10-12% объема крови (принято считать, что объем крови эквивалентен 1/16 веса тела).
Острую постгеморрагическую анемию можно вызвать путем однократного кровопускания. При этом берут 40-50% объема крови за 2 дня до занятия.
Методика подсчета количества эритроцитов
Из прокола краевой вены предварительно обработанного эфиром уха кролика набирают в эритроцитарный меланжер (рис. 16) кровь до метки 0,5 и разводят до метки 101 1% раствором поваренной соли (разведение в 200 раз). В течение 2-3 минут меланжер встряхивают (рис. 17). Затем 5-ю или 6-ю каплю смеси из меланжера помещают под заранее притертое покровное стекло счетной камеры (рис. 18, 19). Эритроциты подсчитывают в 5 больших (т. е. в 80 малых) квадратах сетки Горяева (рис. 20, 21).
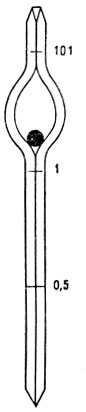
Рис. 16. Эритроцитарный меланжер
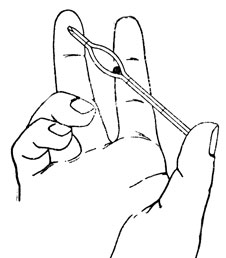
Рис. 17. Встряхивание меланжера
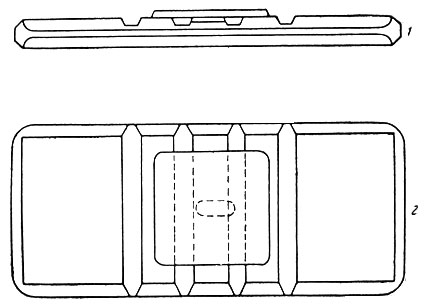
Рис. 18. Схематическое изображение камеры для подсчета форменных элементов крови. 1 - вид сбоку; 2 - вид сверху
Рис. 19. Помещение капли смеси в камеру
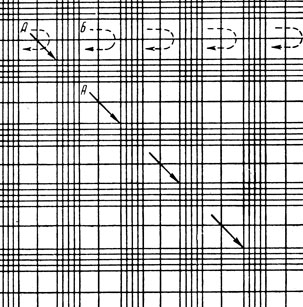
Рис. 20. Сетка Горяева и порядок передвижения сетки при подсчете эритроцитов (А) и лейкоцитов (Б)
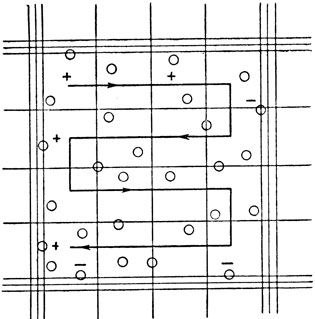
Рис. 21. Порядок подсчета эритроцитов в пределах большого квадрата
По числу эритроцитов, имеющихся в 80 малых квадратах, вычисляют количество их в 1 мм3 крови. Для вычисления пользуются формулой:
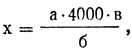
где х - искомое количество эритроцитов;
а - сумма эритроцитов, сосчитанных в 5 больших квадратах;
б - количество сосчитанных малых квадратов;
в - разведение крови (в 200 раз);
4000 - множитель, приводящий объем столбика жидкости в границах малого квадрата (1/4000 мм3) к 1 мм3.
Пример. В 5 больших квадратах (80 малых) сосчитано 456 эритроцитов.
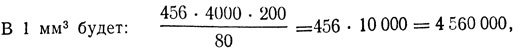
т. е. сумму эритроцитов, сосчитанных в 5 больших квадратах, нужно умножить на 10000.
Для подсчета эритроцитов можно воспользоваться безмеланжерным методом. При этом кровь берут микропипеткой от гемометра (до метки 0,02 мл) и выдувают в пробирку с 3,98 мл 1 % раствора хлористого натрия. После промывания пипетки смесь тщательно встряхивают. Каплю смеси стеклянной палочкой или пипеткой для дистиллированной воды от гемометра вносят в счетную камеру.
Данный метод дает более точные результаты.
Определение количества гемоглобина
В мерную пипетку от гемометра набирают 0,02 мл крови и осторожно выдувают на дно градуированной пробирки, в которую заранее помешают децинормальный раствор соляной кислоты до цифры 2 на шкале грамм-процентов (г %). Мерную пипетку трижды промывают соляной кислотой; смесь встряхивают и оставляют стоять в течение 5 минут. Образующийся солянокислый гематин окрашивает содержимое пробирки в коричнево-желтый цвет. Прибавлением дистиллированной воды выравнивают цвет жидкости в средней пробирке с цветом эталона и получают ответ в грамм-процентах (г %) или единицах (%).
Вычисление цветного показателя
По цветному показателю судят о степени насыщенности гемоглобином каждого эритроцита. За единицу цветного показателя принято 33 μν (микрогаммы) гемоглобина, который находится в эритроците при условии полного его насыщения. Цветной показатель вычисляется по формуле:
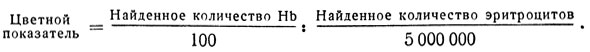
Пример: Найдено, что в крови содержится 85 единиц Нb, в 1 мм3 крови - 4560000 эритроцитов.
При этом:
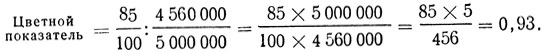
Можно также запомнить упрощенную формулу вычисления цветного показателя: "цветной показатель равен содержанию гемоглобина в процентах, деленному на удвоенные первые две цифры числа эритроцитов (при числе эритроцитов менее миллиона берется только первая цифра)". Применив эту формулу в нашем примере, получим:
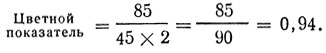
Изготовление прижизненно окрашенного мазка и подсчет ретикулоцитов
На предметное стекло с заранее нанесенной краской бриллиант-крезилблау (1 г краски на 80 г этилового спирта) наносят мазок крови и тотчас (!) помещают на 6-8 минут во влажную камеру. Затем мазок извлекают из камеры, высушивают и рассматривают под иммерсией. Ретикулоциты отличаются от обычных эритроцитов наличием базофильной ретикулярной субстанции.
Для облегчения подсчета ретикулоцитов используют счет с окошечком (рис. 22). Из бумаги вырезают кружок по размерам окуляра микроскопа. В центре кружка прорезают отверстие размером 1,5×1,5 мм. Кружок, вложенный в окуляр, ограничивает поле зрения и тем самым значительно облегчает счет. Осторожно передвигая мазок, сосчитывают 1000 клеток и определяют приходящееся на них количество ретикулоцитов. В целях экономии времени на студенческом занятии допустим подсчет меньшего количества клеток (200-300).
Рис. 22. Последовательность приготовления окошечка для подсчета ретикулоцитов
Изготовление окрашенного мазка и изучение картины периферической крови
На предметное стекло наносят тонкий мазок крови, который после высыхания фиксируют в течение 3 минут в метиловом спирте и заливают на 20-25 минут свежеприготовленной краской Гимза (1 мл спиртового раствора краски Гимза на 9 мл дистиллированной воды). Краску смывают водопроводной водой. Излишек влаги удаляют фильтровальной бумагой, мазок сушат и рассматривают с иммерсией. Студенты зарисовывают картину периферической крови у интактного и анемизированного кроликов (рис. 23).
Рис. 23. Последовательность изготовления мазка крови
Все данные, полученные студентами, выписывают на доску, выводят средние показатели для контрольного анемизированного кролика. После совместного обсуждения результатов опыта с преподавателем студенты делают соответствующее заключение по данному занятию в своих протоколах.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'