Занятие 13. Аллергия
Цель занятия
Изучить некоторые проявления и основные механизмы развития аллергических реакций организма.
Подготовка к занятию
Студенты готовятся к данному занятию в объеме следующих вопросов.
1. Аллергия как извращенная реакция организма на антигенный раздражитель.
2. Основные причины и механизмы возникновения и развития аллергических реакций.
3. Значение нервной системы в развитии аллергических реакций.
4. Различные виды аллергии и их патогенез.
Техническое оснащение занятия*
* (Из расчета на 2-6 студентов.)

Наименование опытов и методика их проведения
Опыт 1. Феномен Артюса (демонстрация). За 20-30 дней до начала занятий кролику, лучше серому, вводят стерильно под кожу по 5 мл нормальной лошадиной сыворотки пятикратно с 5-6-дневными промежутками.
После 3-й, 4-й сенсибилизирующей инъекции на месте введения сыворотки образуется инфильтрат с последующим развитием острого гиперергического воспаления с образованием некроза.
Опыт 2. Анафилактическая реакция сосудов и сердца лягушки. Для опыта берут лягушек, сенсибилизированных троекратным-пятикратным введением в лимфатический мешок по 0,3 мл нормальной лошадиной сыворотки, с 3-4-дневными промежутками (лягушек берут крупных и крепких - летних или осенних, их содержат при температуре 20-22°).
А. Анафилактическая реакция брыжейки. Сенсибилизированную лягушку обездвиживают введением 10% уретана (1,5-2 мл в спинной лимфатический мешок), укрепляют на пробковой дощечке спинкой кверху, правым боком к круглому отверстию. Затем извлекают брыжейку из брюшной полости и растягивают над круглым отверстием дощечки. Заметив основные показатели исходного кровообращения (степень кровенаполнения, просвет кровеносных сосудов, скорость кровотока и др.), наносят на брыжейку 5 капель антигена. После этого уже через 3-5 минут наблюдается выхождение форменных элементов крови из сосудов брыжейки в окружающие ткани. Некоторые мелкие сосуды при этом совсем запустевают, форменные элементы в них отсутствуют, но контуры стенок все же ясно видны. Еще через 1-2 минуты возникает замедление тока крови и стаз в более крупных сосудах брыжейки (в отдельных случаях стаз развивается уже в первые 2-3 минуты после нанесения на брыжейку антигена).
Б. Анафилактическая реакция сердца лягушки. Сенсибилизированную лягушку укрепляют на пробковой дощечке животом кверху. У животного обнажают мышцы передней грудной стенки. Пинцетом захватывают и приподнимают грудину, удаляют ее нижнюю половину, обнажают сердце, снимают перикард. Верхушку сердца захватывают серфином, соединенным с плечом рычажка для записи сокращений сердца на кимографе.
При нанесении на сердце сенсибилизированной лягушки 6 капель нормальной лошадиной сыворотки наблюдается изменение сердечных сокращений (ритм сердца становится неправильным, амплитуда сокращений сначала усиливается, а затем ослабляется, вплоть до временной остановки). Почти во всех случаях после отмывания сердца физиологическим раствором сердечная деятельность постепенно восстанавливается до нормы.
Через 15 минут на сердце вновь наносят 6 капель прежнего антигена. При этом реакция со стороны сердца отсутствует или же проявляется значительно слабее.
Опыт 3. Изменение возбудимости седалищного нерва сенсибилизированной лягушки при воздействии на него антигена, Сенсибилизированную лягушку обездвиживают разрушением спинного мозга и фиксируют на дощечке спинкой кверху. Седалищные нервы на обеих лапках выделяют, берут на лигатуру и перерезают на уровне середины бедра. Затем электрическим током от санного индукционного аппарата или стимулятора раздражают периферический конец одного из нервов и определяют наименьшую силу тока, при которой еще сохраняется двигательная реакция конечности. После этого на периферический конец нерва наносят 5-6 капель антигена и через 3-5 минут снова испытывают состояние возбудимости этого нерва на электрический раздражитель прежней силы (возбудимость нерва значительно падает).
Увеличивают силу тока до тех пор, пока раздражение седалищного нерва не вызовет ответной двигательной реакции конечности. Таким образом, устанавливают, что действие антигена изменяет возбудимость седалищного нерва сенсибилизированной лягушки.
На второй конечности той же лягушки проводят аналогичный контрольный опыт с раздражением электрическим током седалищного нерва в условиях нанесения на периферическую часть нерва физиологического раствора. Возбудимость седалищного нерва при этом не меняется.
Опыт 4. Определение активности холинэстеразы крови морской свинки до и после введения разрешающей дозы антигена (при анафилактическом шоке).
В опыте необходимо определить* время, необходимое для того, чтобы под влиянием холинэстеразы крови из избытка ацетилхолина образовалась уксусная кислота в количестве, эквивалентном соответствующему количеству 0,01 н. раствора едкого натра.
* (Определение проводится по модифицированному методу Г. В. Правдич-Неминской, ДАН СССР, 1949, 65, 3.)
В два химических стаканчика наливают но 19,5 мл дистиллированной воды. Один стаканчик служит для определения активности холинэстеразы крови до анафилактического шока, другой - после шока. На микропипетке делают отметку восковым карандашом на линии, обозначающей 0,04 мл.
Протирают ухо морской свинки смоченным в спирте ватным шариком, делают прокол вены уха иглой и, выждав накопление большой капли крови, набирают кровь в микропипетку в объеме 0,04 мл. Кончик пипетки обтирают ватой, кровь немедленно выдувают в стаканчик № 1 и смешивают с дистиллированной водой. В стаканчик добавляют 0,5 мл раствора бромтимолблау и тщательно перемешивают с раствором гемолизированной крови.
Пипеткой (5 мл) переносят по 5 мл смеси в две пробирки: опытную и контрольную. Обе пробирки метят и ставят в водяную баню при 38° на 3 минуты. Затем приливают в опытную пробирку 0,1 мл раствора ацетилхолина (1:250) и добавляют по 0,05 мл 0,01 н. едкого натра до тех пор, пока не появится заметная разница в окраске раствора опытной и контрольной пробирок. Вновь ставят обе пробирки в водяную баню при 38° и наблюдают за выравниванием цвета растворов в пробирках, на что требуется 10-20 минут.
Когда в обеих пробирках цвет раствора станет одинаковым, их вынимают из воды и приливают в опытную пробирку 0,1-0,2 мл 0,01 н. едкого натра, пускают секундомер и вновь ставят пробирку (опыт) в баню при 38°.
Отмечают по секундомеру время, когда цвет раствора в опытной пробирке не будет отличаться от цвета раствора в контрольной пробирке.
Активность холинэстеразы определяют по формуле:
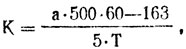
где К - активность холинэстеразы, соответствующая тому количеству гамм ацетилхолина, которое разрушается одним миллилитром данной крови в 1 минуту;
а - количество миллилитров сантинормального раствора едкого натра, добавляемого в опытную пробирку повторно после инкубации (0,1 или 0,2 мл);
500 - разведение крови (0,04:20 мл);
163 - коэффициент (молякулярный вес ацетилхолина);
60 - время в секундах;
Т - замеченное по секундомеру время в секундах;
5 - количество смеси в миллилитрах, наливаемой в пробирки.
По окончании определения активности холинэстеразы определяют время свертывания крови у той же подопытной морской свинки.
Опыт 5. Определение времени свертывания крови у подопытной морской свинки до и после анафилактического шока - по методу Мас-Магро.
На парафинированное часовое стеклышко помещают каплю вазелинового масла. В пипетку от гемоглобинометра Сали, промытую вазелиновым маслом, набирают до метки 20 мм3 кровь из ушной вены подопытной морской свинки и немедленно выдувают в каплю масла на часовом стеклышке. В этот момент отмечают время в секундах как начало определения. Каждые 2 минуты кровь из-под вазелинового масла насасывают в пипетку и вновь выдувают в каплю масла, каждый раз при этом протирая кончик пипетки фильтровальной бумагой. Отмечают время, когда кровь не засасывается в пипетку, т. е. регистрируют время свертывания крови.
Опыт 6. Демонстрация анафилактического шока. Сенсибилизированной морской свинке вводят 0,5-1 мл нормальной лошадиной сыворотки в полость сердца или внутривенно и наблюдают развитие анафилактического шока, составляют протокол наблюдений. Затем, независимо от исхода шока, повторно определяют время свертывания крови и активность холинэстеразы.
Опыт 7. Анафилактическая реакция изолированного отрезка кишечника сенсибилизированного кролика. Кролик весом 1,3-1,5 кг, в возрасте 4-5 месяцев сенсибилизируется повторным 5-6-кратным подкожным введением нормальной лошадиной сыворотки с промежутками между инъекциями в 5-6 дней. Сенсибилизированного кролика на занятии умерщвляют кровопусканием, вскрывают брюшную полость, иссекают участок тонкой кишки длиной 6-8 см. Отрезок кишки промывают несколько раз в подогретом до 37° растворе Тироде и прошивают с обоих концов через стенку нитками на стороне, противоположной брыжейке.
Один конец нитки укрепляют на загнутом конце стеклянной трубки, затем ее вместе с кишкой погружают в химический стакан емкостью 100-200 мл, на 3/4 наполненный жидкостью Тироде, которая подогревается до 38° на протяжении всего опыта. Другой конец стеклянной трубки соединяют с кислородным прибором.
Второй конец кишки при помощи лигатуры прикрепляют к рычажку Энгельмана (рис. 12).
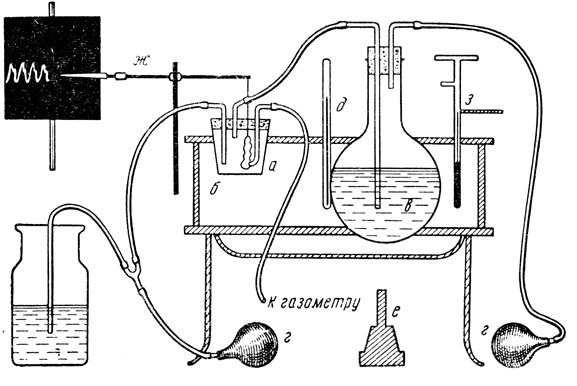
Рис. 12. Схема прибора для изолированного отрезка тонкой кишки. а - стеклянный стаканчик емкостью 100 мл с тремя трубочками: б - водяная баня; в - колба с запасным питательным раствором, г - груши для нагнетания и отсасывания; д - термометр, е - горелка; ж - пишущее перо; з - терморегулятор
Вначале на ленте кимографа записывают сокращение отрезка кишки, после чего в стаканчик с жидкостью Тироде прибавляют 3-4 капли нормальной лошадиной сыворотки (антиген). При этом наблюдается резкое тоническое сокращение кишки.
Спустя 10-15 минут после первого введения сыворотки в питательную жидкость добавляют еще 5-6 капель антигена. Реакция становится значительно слабее (явление десенсибилизации).
Для доказательства преимущественного действия антигена на нервный аппарат изолированного отрезка кишечника проводят опыт с блокированием хеморецепторов атропином. С этой целью от того же кролика берут второй отрезок кишки и готовят изолированный препарат кишечника по описанному выше методу. До введения антигена в стаканчик с жидкостью Тироде прибавляют 1 мл раствора сернокислого атропина (10-3), а затем через 10 минут вводят несколько капель антигена. При этом двигательная реакция со стороны отрезка кишечника отсутствует.
Спустя несколько минут в стаканчик каплями добавляют хлористый барий (10-3), который вызывает резкое сокращение изолированной кишки, так как его действие в основном распространяется не на нервную, а на сократительную субстанцию клетки.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'