Глава I. Методы исследования клеток и тканей
Более 100 лет назад Макс Шультце охарактеризовал клетку как "комочек протоплазмы, внутри которого лежит ядро". Это положение включает в себя и ее современное определение: "Клетка - это элементарная живая система, состоящая из двух частей - цитоплазмы и ядра - и являющаяся основой строения, развития и жизнедеятельности всех животных и растительных организмов" (В. Я. Александров, 1959).
Чрезвычайно важной качественной особенностью клеток является способность к саморегуляции и самовоспроизведению. Ткани могут поддерживать присущее им единство, целостность, устанавливать коррелятивные взаимоотношения с другими тканями. В еще большей степени способны к регуляции своей деятельности отдельные органы и их системы, но они не могут воспроизводить себе подобных. К самовоспроизведению, к полноценной авторепродукции способны только целые организмы и их мельчайшие, в известной мере автономные, составные элементы - клетки.
Клетки, образующие разные ткани, отличаются по форме и по функции (рис. 1). Часто по внешнему виду они абсолютно непохожи одна на другую. Однако в принципе все клетки построены однотипно. Основные структурные компоненты - тело, образованное цитоплазмой, и ядро, состоящее из кариоплазмы (рис. 2А). Цитоплазма и кариоплазма объединяются под названием протоплазмы - живого вещества клетки. В растительных клетках под микроскопом хорошо видна оболочка - образование углеводной природы (рис. 2Б). Она придает клетке постоянную форму. Даже когда живое вещество клетки погибает, ее оболочка сохраняется и может дать полное представление о величине и виде клетки. Первое знакомство с клетками произошло именно по их оболочкам.
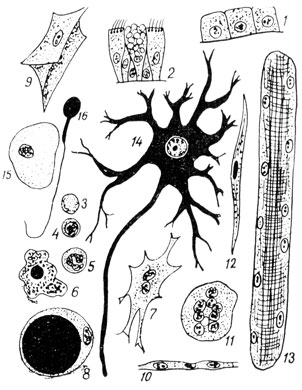
Рис. 1. Клетки животного организма: 1 - однослойный кубический эпителий; 2 - многорядный мерцательный эпителий с реснитчатыми и бокаловидными клетками; 3 - эритроцит; 4 - малый лимфоцит; 5 - специальный лейкоцит, или нейтрофил; 6 - макрофаг; 7 - фибробласт; 8 - жировая клетка; 9 - сухожильная клетка; 10 - эндотелий; 11 - остеокласт; 12 - гладкая мышечная клетка; 13 - мион, миосимпласт, волокно поперечнополосатой скелетной мышечной ткани; 14 - нервная клетка, неврон; 15 - слущенная эпителиальная клетка в ротовой полости; 16 - сперматозоид
По химическому составу основная масса протоплазмы растительных и животных клеток представлена на 98% четырьмя элементами - углеродом, водородом, кислородом и азотом. 1,9% массы протоплазмы составляют натрий, калий, кальций, магний, хлор, железо, сера, фосфор. Оставшиеся 0,1% включают около 50 других химических элементов, входящих в периодическую систему Менделеева. Это так называемые микроэлементы. На каждого из них в клетке приходятся тысячные доли процента, иногда меньше.
Из химических соединений преобладает вода, на долю которой приходится в среднем 2/3 "сырого" веса протоплазмы. Вода, точнее водный раствор неорганических солей, является той необходимой средой, в которой протекают все процессы обмена веществ в клетке.
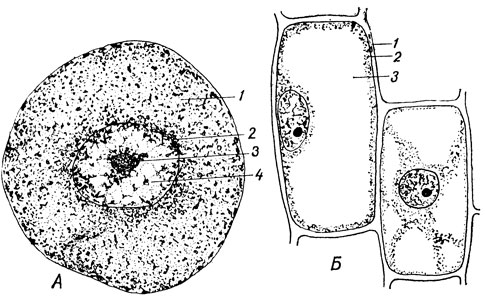
Рис. 2. А - животная клетка: 1 - цитоплазма; 2 - ядерная оболочка; 3 - ядрышко; 4 - кариоплазма. Б - растительная клетка: 1 - целлюлозная оболочка клетки: 2 - цитоплазма; 3 - вакуоль, заполненная клеточным соком
Органические вещества представлены главным образом четырьмя группами химических соединений: белки составляют 10 - 20% сырого веса протоплазмы, липиды - 5%, углеводы - 2% и нуклеиновые кислоты - 2%.
Важнейшие органические вещества - белки и нуклеиновые кислоты. Великий классик марксизма Фридрих Энгельс определял жизнь как форму или способ существования белковых тел. Это положение не потеряло своей силы и сегодня. В основе морфологической организации клетки лежат структурные белки. Биологические катализаторы специфического действия - ферменты, или энзимы, которые участвуют во всех обменных и строительных процессах в клетке, также являются веществами белковой природы. Функция нуклеиновых кислот - синтез белков. Они - тот аппарат, с помощью которого осуществляется воспроизводство белков, сохраняющих при этом свои специфические особенности.
Белки, или протеины, имеют сложное строение и высокий молекулярный вес, который определяется их громадными размерами. Гигантские белковые молекулы являются макромолекулами. Они строятся из аминокислот. Сочетания различных аминокислот и всевозможные варианты их расположения по длине молекулы лежат в основе безграничного разнообразия белков. Макромолекулы некоторых рибонуклеиновых кислот (РНК) приближаются по размерам к белковым, а молекулы дезоксирибонуклеиновых кислот (ДНК) во много раз крупнее - их молекулярный вес может измеряться десятками миллионов.
Углеводы и липиды являются источниками энергии для осуществления всех жизненных процессов в клетке. Из низкомолекулярных органических веществ важная роль принадлежит аденозинтрифосфорной кислоте - АТФ. Несмотря на относительно малое ее содержание (в среднем 0,02 - 0,5% в расчете на сырой вес), с ней связаны почти все энергетические затраты клетки. АТФ относится к числу макроэргических соединений, то есть обладающих связью, богатой энергией. Отщепляя одну из трех молекул фосфорной кислоты и превращаясь при этом в АДФ (аденозиндифосфорную кислоту), она порождает 10000 кал/моль. С помощью специальных органоидов клетки из АДФ затем опять строится АТФ.
Белки, нуклеиновые кислоты и другие макромолекулярные соединения клетки представляют собой коллоиды, а поскольку они образуют основную массу протоплазмы, то она является настоящим коллоидом со всеми присущими ему свойствами, в частности, способностью застудневать и разжижаться. Вместе с тем живое вещество клетки небесструктурно, как обычный коллоид, а обладает очень сложной и закономерной субмикроскопической организацией, о которой удалось узнать главным образом с помощью электронного микроскопа.
Важнейшее место в изучении клеток и тканей принадлежит световой микроскопии. Однако даже самые совершенные оптические микроскопы обладают относительно низкой разрешающей способностью. Разрешающая способность микроскопа - это наименьшее расстояние между двумя точками, при котором они видны не слитно, а раздельно. Теоретически рассчитанный предел разрешающей способности оптического микроскопа составляет 1/3 длины волны используемого источника света. Поскольку длина волн видимого света колеблется в пределах 0,4 - 0,78 мк, минимальный размер структур, которые могут быть хорошо различимы в световой микроскоп, равняется 0,2 мк.
При использовании в качестве источника освещения ультрафиолетовых лучей с длиной волны 0,2 - 0,3 мк предел разрешения составляет 0,1 мк, то есть разрешающая сила микроскопа удваивается. Поскольку ультрафиолетовые лучи зрительно не воспринимаются, то изображение приходится фотографировать или использовать специальный флуоресцирующий экран, на который проектируется изображение. Так производится качественный анализ тех клеточных соединений, которые способны поглощать ультрафиолетовые лучи строго определенной длины волны.
В настоящее время разработаны методы не только качественного, но и количественного определения разных веществ в клетке по степени поглощения ими световых или ультрафиолетовых лучей с определенной длиной волны. Большему поглощению лучей соответствует большая концентрация исследуемого вещества. Методы эти получили наименование цитофотометрии.
С помощью световой микроскопии изучаются фиксированные и окрашенные клетки и ткани. Фиксация означает закрепление прижизненного строения. Для выявления разных структур существуют различные способы фиксации. Их разрабатывают, сравнивая картины, полученные после применения разных фиксаторов, с прижизненным состоянием объекта. Наиболее распространенные фиксирующие жидкости - формалин и этиловый спирт. Они применяются отдельно или в смеси друг с другом. Широко используются фиксирующие жидкости, в состав которых входят сулема, пикриновая и уксусная кислоты.
Фиксированные, кусочки тканей непригодны для непосредственного изучения под микроскопом, поэтому из них изготовляют тонкие срезы. Для придания зафиксированному материалу достаточной плотности чаще всего используют заливку в парафин. Кусочки ткани обезвоживают, проводя последовательно через этиловый спирт разной крепости, вплоть до абсолютного (100°). Затем пропитывают жидкостью, которая смешивается как со спиртом, так и с парафином. Наиболее употребительны для этой цели ксилол и хлороформ. Вытеснив спирт ксилолом либо хлороформом, кусочки ткани пропитывают расплавленным парафином. После охлаждения парафина они оказываются как бы замурованными в нем. Из такого парафинового блока легко могут быть получены на специальном приборе (микротоме) очень тонкие срезы толщиной в несколько микрон. Время фиксации, обезвоживания, пропитывания ксилолом и парафином зависит от характера ткани и размеров кусочка.
При исследовании веществ, растворяющихся в спирте, ксилоле и хлороформе, или при необходимости быстро получить препарат применяют метод резания кусочков на замораживающем микротоме. Для замораживания используют обычно жидкую углекислоту или специальный морозильный столик, на который помещают кусочек ткани в капле воды. В результате кусочек оказывается замурованным в толще льда, что позволяет получать из него срезы толщиной 10 - 20 мк. Такие срезы могут быть сразу же подвергнуты соответствующей окраске.
Со срезов, полученных из парафиновых блоков, парафин должен быть удален до окраски. Для этой цели идут в направлении, обратном тому, которому следовали при заливке: парафин снимают, помещая срезы в ксилол, затем вытесняют ксилол спиртом, а спирт - водой. При пользовании спиртовыми растворами красителя последняя процедура отпадает.
Самыми распространенными красителями, используемыми для окраски срезов, являются гематоксилин и эозин. Они применяются для получения обзорных препаратов. Гематоксилин окрашивает в синий цвет ядра клеток, эозин - в розовый цвет цитоплазму. Вообще ядра окрашиваются основными красителями, проявляя базофилию. К их числу относятся красные сафранин, квасцовый кармин, основной фуксин, синий тионин и метиловый зеленый. Цитоплазма, наоборот, окрашивается кислыми красителями, например, эозином, оранжевым Ж. Применяют также комбинированную окраску двумя или несколькими красителями для одновременного (выявления различных структурных элементов, по-разному относящихся к данным краскам.
Большого развития достигли методы цито- и гистохимического исследования, основанные на применении специфических окрасок для выявления в клетках и тканях различных химических веществ. Разработаны методы, позволяющие определять активность многих десятков ферментов. Они состоят в выявлении с помощью окрашивания специфических продуктов ферментативных реакций. Существуют многочисленные способы определения в клетках и тканях неорганических элементов.
Значительное место в технике микроскопических исследований занимают методы импрегнации металлами различных клеточных и тканевых образований. Они основаны на выпадении металла в виде черни на поверхности тех или иных структур при восстановлении из раствора его солей.
Одним из достижений современной науки является исследование клеток и тканей с помощью электронного микроскопа. Ход лучей в оптическом и электронном микроскопах одинаков, хотя в последнем вместо света используется поток электронов, исходящий из раскаленной вольфрамовой нити, помещенной в вакуум, и ускоренный электрическим полем. Объективу и окуляру светового микроскопа в электронном соответствуют магнитные катушки, отклоняющие нужным образом мчащиеся электроны. Как и в ультрафиолетовом микроскопе, изображение фотографируется или просматривается на флуоресцирующем экране.
Разрешающая способность электронных микроскопов чрезвычайно велика и у самых новейших из них ниже 2 Å (1 Å=0,0001 мк). С помощью электронного микроскопа можно добиться увеличения в 1 миллион раз, в то время как наибольшее увеличение светового микроскопа почти в 1000 раз меньше. Электронномикроскопические исследования проводят на материале, фиксированном и залитом в специальные плотные среды. Очень тонкие срезы готовят на ультрамикротомах.
В современных микроскопических исследованиях важная роль принадлежит авторадиографии, основанной на применении меченых атомов. Желая проследить путь того или иного соединения в клетках и тканях, участие в обменных процессах, один из его атомов заменяют радиоактивным изотопом. В качестве меченых атомов чаще всего используют H3, C14, P32, S35, J131. Меченые молекулы вводят в живой организм с пищей или посредством инъекций. Через определенное время берут кусочек ткани или органа, фиксируют его, заливают в парафин и готовят обычные срезы. Затем удаляют парафин, покрывают срезы тонким слоем фотоэмульсии и помещают на некоторое время в темноту. В тех местах срезов, где в клетках или в межклеточном веществе находились радиоизотопы, фотоэмульсия засвечивается. При проявлении фотоэмульсии в этих точках бромистое серебро восстанавливается до металлического, имеющего на препарате с закрепленной фотоэмульсией вид черных зерен - треков. Докрашивая препарат обычным способом соответствующим красителем, получают возможность наглядно видеть, с какими именно клетками и структурами связаны эти треки - следы обменных процессе, в которых приняли участие изучаемые соединения, содержащие меченые атомы.
Радиоавтографы получают также, вводя меченые соединения в среду, в которой культивируют ткани.
Эксплантация - культивирование клеток и тканей вне организма - относится к числу важных методов их прижизненного исследования. Мелкие, с булавочную головку, кусочки тканей помещают в специальные флаконы Карреля или во влажную камеру, образованную луночкой в толстом предметном стекле, прикрытой покровным стеклом. Кусочек, находящийся в капле питательной среды, свисает внутрь этой камеры. Если клетки данной ткани способны к делению, они усиленно пролиферируют в периферической части эксплантата, и за его пределами возникает зона роста. В краевой части этой зоны клетки лежат очень тонким слоем, часто в один ряд, легко доступны наблюдению и изучению разными методами прижизненного исследования. Для выявления деталей культуры фиксируют и подвергают обычной гистологической обработке.
Ткани теплокровных животных культивируют при температуре тела в термостате. Через определенный промежуток времени культуры должны пересеваться, чтобы избежать их гибели в результате накопления в окружающей среде токсичных продуктов жизнедеятельности. При регулярном изъятии кусочков из зоны роста и перемещении их в свежую питательную среду культуры практически могут поддерживаться неопределенно долго. Известны культуры, которые таким способом существуют уже более полувека.
В настоящее время в исследовательских целях широко применяются однослойные культуры, получаемые из разобщенных специальной обработкой тканевых клеток. Особое значение для изучения свойств отдельных клеток приобрели способы выращивания их колоний, обозначаемых как клоны.
Методы, позволяющие производить прижизненно тончайшие операции на клетках и их производных, объединяются под названием микрохирургия, или микрургия. Подобные вмешательства осуществляются с помощью особого прибора - микроманипулятора. Важнейшими его частями являются обычный оптический микроскоп и "ассистенты", в которые крепятся инструменты. Благодаря системе винтов эти инструменты могут совершать движения в различных направлениях. При этом грубые движения, производимые рукой, переводятся в очень тонкие и точные, за которыми следят глазом под микроскопом.
В качестве инструментов употребляются чаще всего тончайшие иглы и микропипетки, оттягиваемые над пламенем микрогорелки. Иглой, вставленной в один из "ассистентов", фиксируют нужную клетку, а другой иглой, укрепленной во втором "ассистенте", производят необходимые манипуляции. Например, удаляют ядро, надрывают ядерную оболочку или изымают хромосому из делящейся клетки. С помощью микропипетки высасывают из клетки сок или инъецируют в нее какое-нибудь вещество, вводят прижизненный краситель, в частности, в качестве индикатора - нейтральный красный, цвет которого меняется в зависимости от pH среды (в щелочной среде - оранжевый, в кислой - малиново-красный).
Прижизненное окрашивание используют в разных вариантах. Кусочки тканей можно непосредственно погружать в раствор того или иного малотоксичного витального красителя (чаще всего нейтрального красного), а затем изучать клетки прижизненно под микроскопом. Можно вводить прижизненный краситель в организм, например, в брюшную полость, а затем непосредственно исследовать его клетки и ткани. Животному прижизненный краситель можно вводить с пищей или в полость тела, в кровь, а затем фиксировать различные органы и готовить из них препараты, слегка окрашивая контрастирующими красителями. Витальные краски, употребляемые для этой цели, естественно, не должны растворяться жидкостями, используемыми при изготовлении препаратов. Таким достоинством обладает, например, трипановая синь.
Для изучения свойств отдельных клеточных компонентов, их химических особенностей в практику цитологических исследований вошли методы дифференциального, фракционного центрифугирования. В пробирки центрифуги с особой жидкостью закладывают измельченную ткань и, увеличивая последовательно число оборотов, повышают центробежную силу. Наиболее тяжелые части клетки - ядра - оказываются в осадке при центробежной силе, равной 5000 - 10000 g. После удаления осадка и центрифугирования надосадочной жидкости при центробежной силе, составляющей 20 000 g, в осадке оказывается следующая по тяжести фракция клеточных компонентов (митохондрии).
Важное значение для прижизненного исследования клеток имеют различные специальные виды микроскопии. Фазово-контрастная микроскопия позволяет обнаруживать такие структуры, которые в обычный световой микроскоп не видны. Принцип фазово-контрастного устройства базируется на физической закономерности изменения фазы у лучей, проходящих через прозрачные, но отличающиеся по показателю преломления от окружающей среды объекты. Запаздывание световых волн, то есть сдвиг фазы, тем больше, чем больше отличаются по показателю преломления объект и среда. Возрастает сдвиг фазы и параллельно толщине объекта. В фазово-контрастном устройстве, комбинируемом с обычным оптическим микроскопом, разность фаз трансформируется в разность амплитуд колебания световых волн, иначе говоря, в разность интенсивности освещения, и в итоге возникает контрастное изображение. Оно видимо для глаза и может быть зафотографировано.
Интерференционный микроскоп обладает большими возможностями, чем фазово-контрастный. Сдвиги фаз трансформируются в нем в цветовые изменения, и разные компоненты клетки приобретают различную окраску, что определяется их плотностью. С другой стороны, по цвету можно делать вывод о плотности изучаемых структур.
Микроскопия в темном поле основана на боковом освещении объекта. Достигается это применением особого темнопольного конденсора. Благодаря заслонке - диафрагме, расположенной в центре конденсора, к объекту доходят только косые лучи. Отражая эти лучи, становятся заметными на темном фоне даже такие частицы, размер которых ниже разрешающей способности светового микроскопа. Вот почему данный метод был назван сначала ультрамикроскопией. Чтобы эффект свечения структур на темном фоне был понятнее, стоит напомнить, как обнаруживаются пылинки в воздухе темной комнаты, когда в нее проникает луч света. По ходу луча возникают тысячи искрящихся точек - отражений пылинок, которые до этого в освещенной комнате были неразличимы.
Поляризационная микроскопия применяется для обнаружения и изучения в клетках и тканях анизотропных, то есть двоякопреломляющихся структур. Входя в подобные тела, пучок световых лучей раздваивается, и свет оказывается поляризованным в двух взаимно перпендикулярных плоскостях. Для каждой из этих плоскостей имеется свой показатель преломления, отвечающий скорости распространения в данной плоскости светового пучка. Свечение структур в темном поле поляризационного микроскопа свидетельствует о присущем им двойном лучепреломлении, обусловленном строго правильным расположением молекул. С помощью поляризационного микроскопа можно установить характер расположения молекул в изучаемых анизотропных структурах.
Флуоресцентная, или люминесцентная микроскопия основана на свойстве некоторых веществ светиться под воздействием световых лучей. Явление это носит название собственной, или первичной флуоресценции. Длина волны возбужденного света превышает длину волны источника света, в качестве которого используют синие или ультрафиолетовые лучи.
Гораздо шире используется способность веществ к вторичной флуоресценции - свечению после пропитывания их флуорохромами, так называемыми люминесцентными красителями. Особое место среди этих красителей принадлежит акридину оранжевому. При обработке клеток этим красителем содержащаяся в них дезоксирибонуклеиновая кислота под люминесцентным микроскопом приобретает зеленый цвет, а рибонуклеиновая - оранжево-красный.
При исследовании живых объектов особая роль принадлежит микрофотографированию наблюдаемых картин, то есть фотографированию их под микроскопом. С помощью микрофотоснимка можно не только документировать виденное, но, как бы закрепив картину какого-то момента изучаемого процесса, в случае надобности вернуться к ней и тщательно проанализировать.
Еще большие возможности в этом отношении предоставляет микрокиносъемка - киносъемка с помощью микроскопа. Используя цейтраферное устройство, можно делать микрофотоснимок через заданные интервалы. Допустим, снимается процесс клеточного деления, который длится 100 минут. Заданный интервал между кадрами -5 секунд. Следовательно, кинолента будет состоять из 1200 кадров. Если пропустить ленту при проекции на экран с обычной скоростью - 20 кадров в секунду, весь фильм пройдет за 1 минуту. То есть при демонстрации на экране процесс ускоряется в 100 раз. Подобную микрокиносъемку с последующим меньшим или большим ускорением зафотографированного процесса академик А. А. Заварзин образно назвал "микроскопом времени".
К тому, что мы рассказали, следует добавить, что многие из описанных методов могут сочетаться друг с другом в разных комбинациях, предоставляя новые возможности для исследования. Например, культивирование тканей можно сочетать с их прижизненной окраской и микрокиносъемкой, а электронную микроскопию - с авторадиографией и гистохимией.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'