Практикум
Кровь
В зависимости от цели анализа кровь берут в различных количествах.
Малые количества крови (1-2 капли) получают у человека уколом ногтевой фаланги пальца, реже мочки уха и у детей грудного возраста из пятки. Для этого применяют иглы одноразового пользования или иглы-скарификаторы со съемными копьями.
Предварительно кожу обрабатывают спиртом, а после взятия крови - спиртовым раствором йода. Первую выступившую после укола каплю крови удаляют ватным тампоном. Ее не используют для анализа, потому что к крови примешиваются поврежденные клетки тканей и некоторое количество тканевой жидкости. Для исследования надо брать лишь свободно поступающую из кровеносных сосудов кровь (не надавливая на палец).
Задание 1. Определение количества форменных элементов в крови
Для физиологии и клиники важное значение имеет определение количества форменных элементов в крови, которое производят под микроскопом с помощью счетных камер или же автоматически действующих электронных приборов - целлоскопов.
Широкое распространение получил метод подсчета форменных элементов в камере Бюркера с сеткой Горяева. Эта камера представляет собой толстое предметное стекло, в центре которого выгравированы две сетки, отделенные друг от друга поперечно расположенным желобком. Центральная часть камеры, где нанесены сетки, углублена по сравнению с остальной поверхностью стекла на 1·10-4 м (0,1 мм) и отделена от боковых частей его продольно расположенными желобками. Таким образом, если на сетку поместить каплю разведенной крови, а сверху накрыть ее покровным стеклом, то образуется щель, в которой заключен слой разведенной крови высотой 1·10-4 м (0,1 мм).
Сетка Горяева состоит из 225 больших квадратов, 25 из которых разделены на маленькие, по 16 в каждом. Квадраты образуются идущими перпендикулярно одна к другой линиями. Сторона каждого квадратика равна 5·10-5 м (1/20 мм), площадь - 4·10-8 м2 (1/400 мм2), а объем, учитывая высоту столба жидкости над квадратиком, будет равен 4·10-9 м3 (1/4000 мм3). При определении количества форменных элементов в 1 л крови необходимо учитывать размеры маленьких квадратиков.
Кровь для подсчета форменных элементов набирают в капиллярные пипетки от гемометра Сали в объеме 20 мм3.
А. Определение количества эритроцитов в крови человека
При определении количества эритроцитов кровь разводят в пробирке в 201 раз (≈200 раз) изотоническим (0,85%) или гипертоническим (3%) раствором хлорида натрия. В последнем эритроциты сморщиваются, становятся рельефными и лучше видны под микроскопом. Эритроциты считают в 5 больших квадратах (деленных на 16 маленьких), расположенных по диагонали сетки Горяева. Считают эритроциты, находящиеся внутри каждого маленького квадратика, а также на верхней и левой его границах. Найденное количество эритроцитов подставляют в формулу:
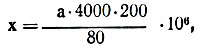
где х - количество эритроцитов в 1 л исследуемой крови; а - содержание эритроцитов в 5 больших (80 маленьких) квадратах; 1/4000 мм3 - объем одного маленького квадратика; 200 - степень разведения крови; 106 - коэффициент для пересчета по международной системе единиц СИ.
Для работы необходимы: микроскоп, счетная камера, стеклянные палочки, пипетки от гемометра Сали, резиновая трубка со стеклянным наконечником (мундштук), градуированные пипетки, пробирки длиной 1·10-1 м и диаметром 1·10-2 м (10×1 см), скарификатор, спирт, вата, спиртовой раствор йода, 3% (0,85%) раствор хлорида натрия.
Ход работы. 1. В предварительно высушенную, чистую пробирку отмерить 4·10-3 л (4 мл) разводящей жидкости и закрыть ее пробкой.
2. На тупой конец пипетки от гемометра Сали надеть мундштук. Скарификатором произвести укол в мякоть пальца. Взяв стеклянный наконечник в рот и погрузив кончик капиллярной пипетки в каплю крови, набрать точно 20 мм3 крови.
3. Осторожно выдуть кровь в пробирку с разводящей жидкостью, промыть ею пипетку и закрыть пробирку пробкой. Содержимое пробирки тщательно (но осторожно) перемешать, держа пробирку вертикально.
4. Концом круглой стеклянной палочки взять из пробирки, наклоняя ее, каплю крови и заполнить счетную камеру. После этого камеру надо накрыть покровным стеклом. При заполнении камеры необходимо обратить внимание на то, чтобы под покровным стеклом не было пузырьков воздуха и разведенная кровь не попадала в бороздки камеры. Лучше пользоваться шлифованным покровным стеклом, которое притирают к стеклу камеры до появления ньютоновых колец. Затем камеру заполняют разведенной кровью по принципу капиллярности.
5. Выждать 1 мин и поместить камеру на столик микроскопа. Под малым увеличением найти сетку счетной камеры и перевести тубус микроскопа на большое увеличение.
6. Произвести подсчет эритроцитов в 5 больших (80 маленьких) квадратах, расположенных по диагонали сетки, придерживаясь указанного выше правила.
7. Вычислить количество эритроцитов в 1 л неразведенной крови по формуле.
Б. Определение количества лейкоцитов в крови человека
При определении количества лейкоцитов кровь разводят в пробирке в 21 (≈20) раз разводящей жидкостью, которая состоит из 3-5% раствора уксусной кислоты, подкрашенной метиленовым синим (жидкость Тюрка). Лейкоциты подсчитывают в 100 больших (1600 маленьких) квадратах сетки Горяева, неразделенных линиями.
Количество лейкоцитов в 1 л крови вычисляют по формуле:
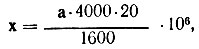
где х - количество лейкоцитов в 1 л исследуемой крови; а - количество лейкоцитов, найденное при подсчете; 1/400 мкл - объем малого квадрата; 20 - степень разведения крови; 1600 - число малых квадратов; 106 - коэффициент для пересчета по международной системе единиц СИ.
Для работы необходимы: микроскоп, счетная камера, стеклянные палочки, пипетки от гемометра Сали, мундштук, пипетка на 1·103 л (1 мл), пробирки длиной 1·10-1 м (10 см) и диаметром 1·10-2 м (1 см), скарификаторы, спирт, вата, спиртовой раствор йода, разводящая жидкость.
Ход работы. 1. В предварительно высушенную, чистую пробирку отмерить 4·10-4 л (0,4 мл) разводящей жидкости и закрыть ее пробкой.
2. Сделать укол скарификатором в мякоть пальца и набрать пипеткой от гемометра Сали 20 мм3 крови.
3. Выдуть кровь в пробирку с разводящей жидкостью, промыть ею пипетку, содержимое пробирки закрыть пробкой и осторожно перемешать при вертикальном положении пробирки.
4. Заполнить счетную камеру.
5. Под большим увеличением микроскопа сосчитать лейкоциты в 100 больших (1600 маленьких) квадратах.
6. Вычислить количество лейкоцитов в 1 л крови по формуле.
Задание 2. Определение гемоглобина в крови с помощью гемометра Сали
Метод основан на калориметрическом принципе, т. е. на сравнении цвета исследуемого и стандартного растворов.
Гемометр Сали состоит из штатива с матовым стеклом и трех пробирок. Две из них запаяны и содержат стандартный раствор солянокислого гематина (соединение гемоглобина с соляной кислотой). Стандартный раствор солянокислого гематина (гемина) обычно готовят из крови, содержащей в 1 л 166,7 или 173 г гемоглобина (указывают в паспорте прибора). В третьей - градуированной пробирке гемометра производят определение содержания гемоглобина в исследуемой крови.
Градуированная пробирка гемометра имеет одну шкалу, которая показывает количество гемоглобина в граммах на 100 мл крови, т. е. концентрацию гемоглобина в грамм-процентах (г%). Для того чтобы перевести полученную цифру в единицы системы СИ (г/л) необходимо умножить ее на 10.
Для работы необходимы: гемометр Сали, скарификатор, 0,1N раствор соляной кислоты, дистиллированная вода, спирт, вата, спиртовой раствор йода.
Ход работы. 1. В градуированную пробирку гемометра налить до метки 3 г% (в гемометре старого типа до метки 10) 0,1N раствор соляной кислоты.
2. Пипеткой от гемометра набрать точно 20 мм3 крови и выдуть ее на дно пробирки. Не вынимая пипетку из пробирки, сполоснуть ее соляной кислотой. Встряхивая пробирку, тщательно перемешать ее содержимое. Смеси дают постоять 5-10 мин.
3. Через 5-10 мин прибавлять по каплям дистиллированную воду до тех пор, пока цвет исследуемой жидкости не будет одинаковым с окраской стандартного раствора.
4. Отметить по шкале, на каком делении стоит уровень раствора солянокислого гематина. Полученную цифру умножить на 10. Эти цифры укажут количество гемоглобина в исследуемой крови в граммах.
Задание 3. Определение СОЭ по методу Панченкова
Для определения скорости оседания эритроцитов (СОЭ) используют унифицированный метод Панченкова.
В крови, предохраненной от свертывания, происходит оседание форменных элементов, в результате чего кровь разделяется на два слоя: верхний - плазма и нижний - осевшие на дно сосуда клетки крови.
Скорость, с которой оседают эритроциты, колеблется в больших пределах в зависимости от состава крови и состояния организма.
СОЭ выражают в миллиметрах в 1 ч (мм/ч). Она равняется у взрослых и здоровых мужчин 1-10 мм/ч, у здоровых (небеременных) женщин 2-15 мм/ч, у новорожденных 0,5 мм/ч.
СОЭ увеличивается при некоторых инфекционных заболеваниях, злокачественных новообразованиях, воспалительных процессах, диабете, а также при ряде физиологических состояний организма, например при беременности (достигая 45 мм/ч на IX месяце беременности). Уменьшение СОЭ отмечается при полицитемии (заболевание, сопровождающееся значительным увеличением количества эритроцитов), при брюшном тифе, вирусном гепатите и т. д.
СОЭ исследуют с помощью аппарата Панченкова. Прибор состоит из штатива и стеклянных капилляров, градуированных от 0 до 100 мм (метка 0 находится в верхней части капилляра).
Капилляр заполняют разведенной в отношении 1:4 нитратной кровью и помещают в гнездо штатива (в строго вертикальном положении) на 1 ч, после чего измеряют в миллиметрах слой плазмы над осевшими клетками крови.
Для работы необходимы: прибор Панченкова, часовое стекло, скарификатор, 5% раствор цитрата натрия, спирт, вата, спиртовой раствор йода.
Ход работы. 1. Промыть капилляр Панченкова 5% раствором цитрата натрия. Набрать этого раствора до метки 50 (Р) и выдуть его на часовое стекло.
2. Дважды набрать в капилляр кровь до метки 0 (К), используя принцип капиллярности. Выдуть кровь на часовое стекло и смешать ее с раствором цитрата натрия.
3. Промыть капилляр раствором цитрата натрия, заполнить его полученной нитратной кровью точно до метки 0 (К) и поместить в штатив строго вертикально.
4. Через 1 ч определить, на сколько миллиметров осели эритроциты.
Задание 4. Определение времени свертывания крови
А. Определение времени свертывания венозной крови
Ход работы. 1. Сухой иглой без шприца из локтевой вены выпустить первые капли на ватный тампон.
2. Набрать в две сухие стеклянные пробирки по 1·10-3 л (1 мл) крови. Тотчас при соприкосновении крови с пробирками включить секундомер.
3. Поместить пробирки с кровью на 2 мин на водяную баню при температуре 37°С.
4. Через 2 мин, а затем через каждые 30 с пробирки наклонять на 45-60°. При этом если кровь не свернулась, то она растекается по стенкам пробирки. Свертывание считают законченным, когда кровь не выливается при переворачивании пробирок вверх дном. В этот момент секундомер выключают.
Примечание. Время свертывания крови выражают в минутах (среднее значение из двух определений). Пределы колебаний времени свертывания крови в стеклянных пробирках у здоровых людей составляют 5-10 мин.
Б. Определение времени свертывания капиллярной крови
Ход работы. 1. Продезинфицировать спиртом мякоть ногтевой фаланги пальца руки. Произвести скарификатором укол, первую выступившую каплю крови удалить.
2. Набрать столбик крови высотой 20-30 мм в сухой капилляр Панченкова и включить секундомер.
3. Перевести столбик крови на середину капилляра и наклонять его в обе стороны на 30-45°. Начало свертывания отмечают от момента замедления движения крови при наклоне капилляра и появления на внутренней стенке капилляра небольших сгустков. Момент полной остановки движения крови соответствует полному свертыванию крови.
Примечание. Время свертывания капиллярной крови в норме: начало 30 с - 2 мин, конец 3-5 мин.
Задание 5. Исследование рН и буферных свойств сыворотки крови
А. Определение рН сыворотки крови с помощью рН-метра
Потенциал некоторых электродов зависит от концентрации водородных ионов в растворе, т. е. связан с рН раствора. Определив потенциал такого электрода, можно рассчитать рН раствора, в который он погружен. Обычно в качестве электродов для определения рН используют стеклянные электроды, что позволяет определять рН в широком диапазоне. Стеклянная мембрана обладает достаточно высоким сопротивлением, поэтому для определения потенциала стеклянного электрода ток усиливают с помощью электронных усилителей, которые вводят в схему современных рН-метров. Шкала таких приборов обычно градуируется в милливольтах и единицах рН.
Для работы необходимы: центрифужные пробирки, шприц на 5·10-3 л (5 мл), центрифуга, рН-метр.
Ход работы. 1. Включить прибор в сеть и прогреть его в течение 20 мин.
2. Залить в стакан микроячейки насыщенный раствор хлорида калия и закрыть стакан крышкой.
3. Вставить в гнездо крышки электролитический ключ и залить в него 1·10-3 л (1 мл) сыворотки крови.
4. Закрепить измерительный и вспомогательный электроды на штативе.
5. Поставить микроячейку на подвижный столик и подвести под электроды.
6. Опустить измерительный электрод в электролитический ключ, а вспомогательный электрод - в гнездо крышки.
7. Подключить выводы электродов к соответствующим клеммам.
8. Переключатель рода работы поставить на рН.
9. Переключатель значений рН перевести в диапазон 4-9. По верхней шкале произвести отсчет показаний прибора, найденная величина будет характеризовать рН сыворотки крови.
Примечание. Получение сыворотки крови: в сухую центрифужную пробирку набрать 3,0·10-3 л (3 мл) крови без стабилизатора. Поместить пробирку на водяную баню при температуре 37°С на 30-40 мин. Через 30-40 мин отсосать отделившуюся сыворотку.
Б. Изучение буферных свойств сыворотки крови
Для работы необходимы: четыре стаканчика, две пипетки на 5·10-3 л (5 мл), две бюретки, сыворотка крови, разведенная в 10 раз изотоническим раствором хлорида натрия, 0,01 N раствор NaOH, 0,1 N раствор НСl, дистиллированная вода, индикаторы - метиловый оранжевый и фенолфталеин.
Ход работы. 1. В один чистый стаканчик налить 5·10-3 л (5 мл) сыворотки крови, в другой - 5·10-3 л (5 мл) дистиллированной воды.
2. Добавить в оба стаканчика по капле метилового оранжевого и титровать 0,1 N раствором соляной кислоты (по каплям, считая их) до появления неисчезающего при взбалтывании красного окрашивания. Титрование следует начинать с воды, которая не обладает буферными свойствами и служит контролем.
3. Аналогичное исследование проводят, добавляя фенолфталеин и титруя 0,01 N раствором едкого натра до неисчезающего в течение 1 мин слабого фиолетового окрашивания.
Задание 6. Определение групповой принадлежности крови
Для определения группы крови берут стандартные гемагглютинирующие сыворотки I, II и III групп и вносят в капельку каждой сыворотки небольшое количество исследуемой крови. Наличие агглютинации указывает на присутствие в эритроцитах обследуемого агглютиногена, одноименного агглютинину, имеющемуся в данной сыворотке. Отсутствие агглютинации указывает, что в исследуемой крови агглютиногена, одноименного агглютинину, содержащемуся в этой сыворотке, нет.
Для работы необходимы: предметные стекла, стандартные гемагглютинирующие сыворотки I, II и III групп двух различных серий и титров, скарификатор, вата, спирт, спиртовой раствор йода.
Ход работы. 1. На чистое предметное стекло или фарфоровую тарелку нанести по капле сывороток I, II и III групп (наносят сыворотки двух серий с неодинаковым содержанием в них агглютининов - антител). Цифрами обозначают расположение сывороток.
2. В каждую каплю сыворотки вносят небольшое количество исследуемой крови (количество сыворотки должно быть примерно в 10 раз больше, чем исследуемой крови). Кровь у обследуемого берут каждый раз чистым уголком предметного стекла.
3. Определение группы крови производят в течение 5 мин при покачивании предметного стекла (или тарелки).
4. По мере наступления агглютинации (но не ранее чем через 3 мин) добавить в эти капли по одной капле изотонического раствора хлорида натрия. Продолжать наблюдение при покачивании стекла в течение 5 мин.
5. Через 5 мин макроскопически (на глаз) определяют наличие или отсутствие агглютинации в каждой капле.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'