Кровь
(Кровь - своеобразное зеркало обмена веществ в организме, биохимические повреждения которого в большинстве случаев находят четкое отражение в этой жидкой ткани.)
Нельзя представить себе жизнь государства, общества без непрерывного движения по дорогам грузов с продуктами питания для населения, сырьем для промышленности. Точно так же не может существовать организм человека или животного без постоянного обмена веществ. По артериям, венам и капиллярам нашего тела постоянно циркулирует кровь, разнося во все органы и клетки организма кислород, воду, питательные вещества. Кровь же уносит из тканей образующиеся в процессе обмена вредные продукты, которые затем выводятся из организма через легкие, кожу, почки, кишечник.
Кровь имеет огромное значение для организма. Быстрая потеря крови приводит к смерти. Кровь, перелитая в вены или артерии, возвращает к жизни умирающих и даже таких больных, у которых наступила клиническая смерть.
В наше время трудно представить себе работу врача, который не учитывал бы данных анализа крови. Наблюдения за составом крови и происходящими в ней химическими превращениями помогают врачу выявлять заболевания, находить пути их лечения.
Методы изучения состава крови непрерывно совершенствуются. Наука почти ежегодно обогащается новыми данными, раскрывающими сложность состава и разнообразие химических процессов, происходящих в крови. Новые же данные о химии крови помогают врачам глубже проникать в тайны болезней, увереннее и эффективнее их лечить. Так как состав крови отражает различные изменения химизма здорового и больного организма, мы уделим этой транспортной ткани (не следует удивляться такому определению: кровь - жидкость, но обладает всеми признаками ткани) особое внимание.
Сотни миллионов лет назад на поверхности нашей планеты появились комочки живого белкового вещества. Прошли миллионы лет, и возникли первые одноклеточные организмы - микроскопические капельки жизни, обитавшие, по-видимому, в водах первичных океанов.
Однако клетка только кажется простым белковым комочком с ядром внутри. В действительности каждая клетка устроена очень сложно, и это позволяет ей осуществлять такие важные функции всякого организма, как питание, рост, движение и размножение.
В результате длительной эволюции из одноклеточных организмов развились разнообразные многоклеточные организмы, населившие воду и сушу. Из них в свою очередь возникла и наиболее высокоразвитая форма живой материи - человек.
Среди миллиардов клеток нашего тела насчитывается более 200 различных форм. Эти клетки утратили способ пость к самостоятельной жизни и выполняют разнообразные, строго дифференцированные функции. Но есть в нашем теле жидкость, которая по своему солевому составу напоминает морскую воду. Эта жидкость - кровь. Кровь представляет собой как бы замкнутое внутри организма море, в котором существуют клетки, во многом напоминающие наших древних, самостоятельно живших предков. Это белые кровяные тельца - лейкоциты.
Жидкая часть крови носит название плазмы. В ее состав входят клетки, которые называют форменными элементами крови: белые тельца - лейкоциты, кровяные пластинки - тромбоциты и красные кровяные тельца - эритроциты. Плазма и форменные элементы крови играют важную роль в ЖИЗНЕС организма. Без эритроцитов наш организм не мог бы дышать, другими словами, не мог бы жить. Вот почему эритроциты составляют основную массу форменных элементов крови: в 1 мм3 крови содержится около 5 млн. этих телец. Следовательно, в 5 л (таков средний объем крови в организме человека) число эритроцитов достигает астрономических цифр. Достаточно сказать, что эритроциты крови одного только человека слоем в одну клетку могут прикрыть площадь в 3800 м2!
Эритроцит представляет собой тельце губчатого строения, мелкие поры которого до отказа наполнены гемоглобином, который помогает обеспечивать органы и ткани кислородом и освобождать их от вредной углекислоты. Природа приспособила эритроциты к выполнению жизненно важной функции - обеспечению дыхания организма.
"Но ведь дыхание осуществляется легкими?" - скажет читатель. Совершенно верно, именно в легких, попадая туда с током крови, эритроциты соприкасаются с вдыхаемым воздухом, из которого гемоглобин захватывает кислород. Богатая кислородом алая кровь доставляет его через сердце и артерии во все органы и ткани. Сюда же в легкие с обратным током крови по венам эритроциты приносят углекислоту в виде неустойчивого соединения с гемоглобином. В этом и заключается сущность процесса дыхания.
С функцией дыхания связано и то обстоятельство, что эритроциты в крови человека и высших животных не содержат клеточного ядра; этим выигрывается место для гемоглобина. Интересно, что кровь многих низших животных содержит ядерные эритроциты. В крови человека и высших животных молодые эритроциты, образуемые костным мозгом, тоже содержат ядра. Но в процессе созревания эритроцитов ядра исчезают.
Выполняя свою работу, эритроциты быстро изнашиваются. Они живут обычно не более трех-четырех месяцев. Изношенные эритроциты попадают на своеобразное кладбище - в селезенку, где они разрушаются, а образовавшиеся обломки с током крови вновь попадают в костный мозг и используются для воссоздания новых эритроцитов.
Белые кровяные тельца - лейкоциты - защищают организм от проникающих в него болезнетворных микробов. При проявлении микробов в какой-либо части организма лейкоциты устремляются к ним, захватывают и уничтожают их. Рассматривая капельку крови под микроскопом, можно увидеть, как лейкоцит направляется прямо к микробу, затем образует отросток, которым захватывает его, втягивает внутрь своего тела и переваривает. Великий русский ученый И. И. Мечников, открывший это явление, назвал белые кровяные тельца фагоцитами (от греческого слова "фагос" - пожирающий).
В органах нашего тела, например в печени, селезенке, находятся и другие фагоциты - особые соединительнотканные клетки. Но в отличие от лейкоцитов они неподвижны и захватывают только тех микробов, которые оказываются вблизи. Лейкоциты же сами активно устремляются к врагу, так как они чувствительны к веществам, выделяемым микробами, и препятствуют дальнейшему проникновению микробной инфекции. Для этого лейкоциты могут выходить из русла кровеносных сосудов в окружающие их ткани.
Масса лейкоцитов гибнет в борьбе с микробами. Если капельку гноя, часто образующегося в местах внедрения микробов, рассмотреть под микроскопом, можно легко убедиться, что основное содержимое ее составляют группы лейкоцитов*.
*(Некоторые виды лейкоцитов содержат гепарин - вещество, препятствующее свертыванию крови.)
Роль эритроцитов и лейкоцитов изучена хорошо. Значительно меньше мы знаем о кровяных пластинках - тромбоцитах. Обычно принимают, что в 1 мм3 крови здорового человека содержится 300 тыс. кровяных пластинок (в 1 г крови 300 млрд.). Но это количество может заметно колебаться даже на протяжении суток.
О роли тромбоцитов высказано много предположений. Вероятнее всего, что эти кровяные пластинки являются центрами, около которых начинается свертывание крови при нарушении целостности сосуда (отсюда и их название "тромбос", что в переводе с греческого значит сгусток).
В крови человека все форменные элементы составляют около 45% ее объема. Остальные 55% приходятся на жидкую плазму. После свертывания крови из плазмы выпадает сгусток белка - фибрин - и остается жидкая часть, которую называют сывороткой. Кровь составляет 7% веса тела (у детей несколько больше). Объем крови может увеличиваться (после введения жидкости) или уменьшаться, но в организме здорового человека эти изменения незначительны, так как между жидкостью внутри сосудов и в тканях поддерживается равновесие. В форменных элементах крови имеются отклонения (иногда с тяжелыми последствиями) при ряде генетически обусловленных ошибок в крови.
Совершенно безобидна, хотя и сравнительно часто встречается передаваемая по наследству аномалия Пельгера. В этом случае у лейкоцитов в значительной степени нарушена способность к сегментации. Какой именно фермент виновен в этом, пока не выяснено. По мнению советского ученого Г. А. Алексеева, функция структурного гена, непосредственно способствующего синтезу такого фермента, при пельгеровской аномалии лейкоцитов не нарушена. Имеются данные, позволяющие предположить, что ген, ответственный за сегментацию ядер лейкоцитов при пельгеровской аномалии, сохранен, но находится в неактивном состоянии. При пельгеровской аномалии и похожей на нее аномалии Штодмейстера неприятным моментом является возможность диагностических ошибок.
Несравнимо опаснее наследственные нейтропении. Они встречаются редко и характеризуются резким уменьшением числа нейтрофилов* в крови и костном мозге. Сушествует несколько форм аномалий нейтронении, которые можно разбить на две группы: постоянные и периодические. Наследование их может происходить как по рецессивному, так и по доминантному типу. Такие аномалии нередко приводят к гибели детей уже в раннем возрасте.
*(Нейтрофилы - лейкоциты с мельчайшей зернистостью, легко красящейся нейтрофильными красителями.)
Где же место ошибки? На этот вопрос пока можно ответить только предположительно. По-видимому, в основе аномалии лежит наследственный дефицит ферментов, ответственных за нормальное развитие нейтрофилов.
Счастливым исключением является доброкачественная наследственная нейтропения, передающаяся по доминантному типу. При этой аномалии больные практически здоровы.
Ткани нашего тела получают питание, дышат и освобождаются от ядовитых веществ, образующихся в результате жизнедеятельности клеток. Подавляющую часть этой работы выполняет кровь, циркулирующая в организме. Кровь течет в сосудах по кровеносной системе, которая состоит из центрального органа - сердца - и соединенных с ним замкнутых трубок различного диаметра - кровеносных сосудов. Если вытянуть в длину все кровеносные сосуды нашего тела, она превысит 100000 км!
Сосуды, несущие кровь от сердца, называются артериями*, начальный отрезок артериальной системы - аортой. Это самый крупный сосуд во всем организме - его диаметр 25-30 мм. Аорта отходит от левого желудочка сердца, и сразу же от нее начинают ответвляться многочисленные артерии. Чем дальше от сердца, тем просвет артерий, разделяющихся на ветви, становится все уже и, наконец, в толще органов они переходят в тончайшие сосуды - артериолы - и дальше в густую сеть мельчайших волосных сосудов, или капилляров.
*(Этот термин неточен, так как слово "артерия" означает "воздухоносная". Оно возникло у древних греков, которые, не зная, что после смерти кровь из артерий уходит в вены, считали, что они всегда заполнены воздухом.)
Капилляры видны только под микроскопом. Через мельчайшие отверстия - поры - в их стенках, состоящих из одного слоя клеток, питательные вещества и кислород, доставляемые по артериям, проникают в окружающие ткани. А из них в капилляры поступают отработанные продукты, в том числе и углекислота. Таким образом, благодаря густой сети волосных сосудов осуществляются процессы питания клеток нашего организма.
При некоторых заболеваниях проницаемость капилляров повышается. Размеры нор увеличиваются, они начинают пропускать уже не только небольшие молекулы питательных веществ - сахара, аминокислот, витаминов, не и значительно более крупные частицы белка и даже красные кровяные шарики. Капилляры становятся хрупкими, легко разрываются и появляются кровоизлияния в ткани. (Кровоизлияние можно, например, обнаружить по образованию синяков под кожей).
Повышенную хрупкость капилляров можно устранить, принимая витамин Р и родственные ему вещества. Такими веществами, по исследованию советских ученых, оказались катехины, содержащиеся в большом количестве в чае, а также во многих фруктах и ягодах. Возможно, что стенки капилляров укрепляют не сами катехины, а гормон надпочечников адреналин, а катехины только выступают в роли "телохранителя" адреналина. Возможно и другое объяснение: катехины устраняют действие фермента - гиалуронидазы, который разрушает входящую в состав стенки капилляров гиалуроновую кислоту. Наконец, возможно, что катехины действуют вообще на всю гормональную систему нашего тела. Как бы то ни было, катехины - верные помощники врача, особенно успешно действующие вместе с аскорбиновой кислотой - витамином С.
Соединяясь между собой, капилляры постепенно переходят в небольшие сосуды - венулы, из которых в свою очередь путем слияния образуются все более крупные сосуды - вены. По этим сосудам кровь, насыщенная отработанными продуктами обмена веществ, оттекает от тканей и устремляется к сердцу. Поступив в правое предсердие, а затем в правый желудочек, венозная кровь перегоняется из него по легочным артериям в легкие. Проходя через капиллярную сеть, оплетающую. легочные пузырьки - альвеолы, кровь отдает углекислоту и получает новый запас кислорода. После этого окисленная кровь оттекает из капилляров легких уже по легочным венам обратно в сердце, в его левое предсердие, затем в левый желудочек, откуда выталкивается в аорту и начинает новый кругооборот по организму.
Таким образом, весь путь крови подразделяется на два отдела: большой и малый круги кровообращения. Большой круг - путь от сердца к органам тела и обратно. А малый круг - путь, который кровь проходит через легкие. Большой круг обеспечивает питание и дыхание тканей, а легочный - освобождает кровь от углекислоты и снабжает ее кислородом.
Кровь, циркулирующая в кровеносной системе животных и человека, приходит в соприкосновение со всеми тканями и клетками организма. В нее поступают самые разнообразные вещества, необходимые для питания организма, и продукты обмена веществ, подлежащие выделению. Поэтому кровь исключительно богата химическими веществами. В крови встречаются более 200 различных веществ, сочетаясь в самых причудливых соотношениях. Но весь этот кажущийся хаос позволяет крови выполнять ее основные функции.
А функции крови очень многообразны. Она обеспечивает дыхание, доставляя кислород к тканям и двуокись углерода от тканей к легким; снабжает ткани питательными веществами, транспортируя их от пищеварительного канала; удаляет продукты обмена, накопление которых вызвало бы самоотравление организма, перенося их от тканей к выделительным органам. Вместе с тканевой жидкостью кровь обеспечивает условия для химических процессов, растворяя вещества, которые вступают в реакции только в таком виде; она же поддерживает водный баланс и постоянную температуру нашего тела. Кровь защищает наш организм от микробов и других вредных факторов, мобилизуя для этого лейкоциты и специальные белковые тела. Она регулирует работу органов и тканей благодаря действию содержащихся в ней химических веществ и гормонов. Можно было бы перечислить еще много других функций крови - этой особой ткани нашего тела.
Хотя о малокровии известно уже с давних времен, только применение специальных методов позволило ознакомиться как следует с этим заболеванием. Выяснилось, что очень часто малокровие в соответствии со своим названием действительно сопровождается уменьшением общего количества крови. Однако встречаются и такие случаи, когда объем крови не только не уменьшен, а даже, наоборот, увеличен, но количество красных телец и гемоглобина все же понижено. Вот почему, предполагая у больного малокровие, врач особое внимание обращает не столько на общий объем крови, сколько на определенно количества красных кровяных телец и гемоглобина.
В организме человека непрерывно происходят биохимические процессы, которые возможны лишь в присутствии кислорода. Чтобы многочисленные клетки организма могли безотказно получать весь необходимый им кислород, должны безупречно работать аппарат дыхания (снабжения организма кислородом) и сердечно-сосудистая система (транспортирование кислорода). Для этого необходимо также определенное количество эритроцитов - переносчиков кислорода.
Ясно, что при малокровии, когда количество красных кровяных телец и гемоглобина уменьшено, снабжение клеток кислородом ухудшается. Кислородная недостаточность вызывает общую слабость, головную боль, сердцебиение, повышенную утомляемость. Кислород нужен всем клеткам, тканям и органам. Когда его мало, страдает весь организм и особенно центральная нервная система.
Существуют различные формы малокровия. Многочисленны и разнообразны причины, вызывающие их.
Химический состав крови находится под контролем "верховного органа" нашего тела - центральной нервной системы, но и сам влияет на нее. Чтобы ясно представить эту зависимость, приведем такой пример.
Если с тех пор, как вы позавтракали, прошло определенное время, пищевые вещества в значительной мере переварены и унесены кровью, то у вас возникает чувство голода. Это значит, что "голодной" стала ваша кровь. Она обеднела пищевыми веществами, химический состав ее изменился. На это изменение в составе крови пищевой центр в мозгу реагирует возбуждением. Он и вызывает ощущение голода. Когда же вы плотно пообедаете, кровь изменит свой химический состав, приобретает свойства "сытой" крови. Такая кровь способствует торможению пищевого центра, возникает ощущение сытости. Но если вы увлечены работой, забыли о еде, то, хотя время еды уже подошло, вы не ощущаете голода - деятельность пищевого центра подавлена другими раздражителями.
Как известно, тело человека и многих животных имеет постоянную температуру. Она поддерживается кровообращением, химическими процессами в крови и тканях. Интенсивная мышечная работа, нервное возбуждение, страх, тревога, радость и другие сильные переживания могут вызвать у нас повышение температуры.
В повседневной жизни мы привыкли отождествлять высокую температуру тела с болезнью. На первый взгляд может показаться странным, что у человека можно вызывать искусственную лихорадку с высокой температурой, т. е. болезнь, с целью лечения другой болезни. Но еще в прошлом веке врачи заметили, что "случайные" сопутствующие заболевания, протекающие с высокой температурой (например, малярия, рожа), иногда способствуют облегчению и даже "исцелению" от некоторых хронических болезней. Метод лечения, при котором у больного вызывают высокую температуру, называется пиротерапией. В последние 10-15 лет врачи стали шире пользоваться пиротерапией. Это произошло благодаря тому, что из разных бактерий удалось приготовить новые высокоактивные и практически безвредные для организма человека препараты, создающие искусственную лихорадку.
На чем основано применение такого метода лечения? Чтобы ответить на этот вопрос, сделаем небольшое отступление и познакомимся с сущностью тех явлений, которые возникают в организме под влиянием болезнетворных начал.
Как известно, любая болезнь сопровождается нарушениями деятельности тканей и органов и прежде всего отражается на нервных механизмах, которые ведают этой деятельностью. Как говорил И. П. Павлов, в организме происходят "поломы", но наряду с этим возникают и другие процессы - приспособительные и компенсаторные изменения функций различных органов и тканей. Это своеобразные защитные реакции организма на повреждения и "поломы". Они очень важны, так как способствуют восстановлению нарушенных функций, заживлению дефектов, т. е. выздоровлению.
Если бы в нашем организме в ходе болезни не возникали приспособительные процессы, сломанные кости не срастались бы, не заживали бы раны, болезнь не оканчивалась бы выздоровлением.
Все эти приспособительные реакции, ярко проявляющиеся только при заболеваниях, вырабатывались в организме человека тысячелетиями во взаимодействии с внешней средой, в борьбе за существование. К числу таких приобретенных в процессе эволюции средств приспособления к болезнетворным влияниям принадлежит и способность организма человека реагировать на действие многих раздражителей - микробов и их ядов, на повреждения тканей самого организма, в том числе временным повышением температуры тела. Повышение температуры ускоряет течение химических реакций, лежащих в основе процессов обмена веществ в клетках. Это создает в свою очередь более благоприятные условия для преодоления болезни, так как повышается деятельность клеток и органов, выполняющих защитные функции в организме.
Если это так, то сама лихорадка не болезнь, а одна из защитных реакций больного организма. Почему же все-таки врачи добиваются снижения температуры, применяя различные средства? Почему при снижении температуры чаще всего заметно улучшается самочувствие больного?
Дело в том, что снижение температуры тела в подобных случаях отнюдь не причина наступившего улучшения в течении болезни, а его следствие. В это время, как правило, стихают и другие, скрытые от поверхностного наблюдения патологические нарушения и реакции. Падение же температуры служит лишь самым ярким и заметным симптомом перехода к выздоровлению. А бывает иногда и наоборот: снижение температуры в ходе болезни совпадает с таким моментом, когда иссякают защитные силы организма, и тогда оно становится грозным симптомом. Это случается, например, при токсической форме дифтерии.
В клетках большинства бактерий содержатся различные соединения жироподобных веществ - так называемые липополисахаридные комплексы (от греческого слова "липос" - жир) и разнообразные группы белковых молекул. Именно эти соединения и придают бактериям характерные для каждого вида свойства. Путем расщепления и разрушения белковых частей клетки в результате длительной очистки удается выделить липополисахаридные комплексы в относительно чистом виде. Многочисленные исследования показали, что эти соединения почти не обладают первоначальными токсическими свойствами, но введенные в организм в ничтожных дозах вызывают лихорадку. Такие препараты получили название очищенных пирогенов (от греческого слова "пирос" огонь). Эти препараты обладают и другими ценными свойствами. Вызывая раздражение теплорегулирующих центров в головном мозге и в связи с этим кратковременный приступ лихорадки, очищенные пирогены стимулируют в организме функции различных органов. В крови возрастает количество гормонов гипофиза, имеющих большое значение для регулирования обмена веществ в клетках. Усиливается деятельность других желез внутренней секреции и коркового вещества надпочечников. Эти реакции играют важную роль, так как повышают сопротивляемость организма.
Кроме того, пирогены увеличивают проницаемость мозгового барьера, препятствующего переходу из крови в мозг защитных антител, увеличивают количество лейкоцитов в крови и усиливают их способность обезвреживать микробы и продукты их распада. Пирогены снижают также кислотность желудочного сока. Увеличивают кровообращение в почках и печени, что создает более благоприятные условия для функции этих органов.
Особенно важной в практическом отношении оказалась способность пирогенов в какой-то мере усиливать восстановительные процессы в нервной, мышечной и других тканях организма. Одновременно с этим они препятствуют образованию плотной грубой рубцовой ткани на месте повреждения, что в свою очередь облегчает восстановление нервных и мышечных волокон. Под действием пирогенных препаратов в некоторых случаях становятся более мягкими и даже частично рассасываются старые рубцы, нарушающие функции тех или иных органов.
Как показали наблюдения, подобные сдвиги в организме появляются при введении очень малых доз пирогенов, которые еще не вызывают лихорадки. Повышение температуры тела лишь усиливает действие этих веществ.
Приведенный здесь далеко не полный перечень сдвигов, вызываемых бактериальными пирогенами в организме, делает в известной мере понятным их применение при лечении ряда столь несходных между собой болезней.
Конечно, пиротерапия не панацея. Она не может заменить всего многообразия существующих приемов специфического лечения различных болезней. В одних случаях она может лишь усилить эти приемы, а в других - воздействовать на такие восстановительные процессы в организме больного, которые пока не удается стимулировать другими способами.
При некоторых заболеваниях температура тела повышается особенно резко. В таких случаях химический состав крови играет важную роль. Дело в том, что при инфекционных заболеваниях идет усиленный распад как клеток и тканей нашего тела, так и напавших на него болезнетворных микробов. Образуются ядовитые вещества, которые, наводняя кровь больного, разносятся ею по всем органам и тканям тела. Попадают они и в головной мозг, в котором есть специальный центр, поддерживающий температуру тела на одном уровне. Доставленные кровью ядовитые вещества - их называют пирогенными - раздражают этот центр, нарушают его деятельность, и температура нашего тела "скачет". Однако повышение температуры обычно свидетельствует, что защитные силы организма энергично борются с вторгшейся в организм инфекцией. Поэтому особенно коварны заболевания, на которые организм человека не отвечает повышением температуры. Кто из нас не слыхал о "бестемпературном" гриппе. Врачи очень не любят, когда болезнь, обычно сопровождающаяся высокой температурой, протекает без ее повышения. Это тревожный сигнал о том, что организм не способен оказать должного сопротивления болезни.
Состав крови нормального, здорового организма довольно постоянен. Конечно, постоянство это относительно, и колебания в содержании некоторых веществ довольно большие*. Но современная биохимия уже накопила проверенные данные, которые можно считать химическими нормативами крови. Они позволяют в известной степени судить о том, как протекают химические реакции обмена веществ в здоровом организме. А так как почти все заболевания человека являются следствием нарушений обмена веществ, то изменение содержания и активности той или иной химической составной части крови позволяет врачу судить о характере заболевания, установить его, предсказать исход, судить об эффективности разных видов лечения.
*(Немалую роль при этом играют возраст, прием пищи (обычно химизм крови исследуют натощак) и такие состояния, как беременность.)
О содержании в крови различных веществ, например Сахаров, чаще всего судят на основании химического анализа: при помощи специальных реактивов, дающих с сахарами цветные реакции, определяется сначала их присутствие в крови, затем проводят количественный учет. Результаты такого анализа выражают в весовых единицах, например в миллиграммах на 100 г (мл) крови, сыворотки или плазмы крови (эту единицу измерения обозначают мг %).
Но в ряде случаев присутствие определенного химического вещества открывают по специфическому действию, как говорят физиологи, по его активности. О присутствии и количестве ферментов в крови (в жидкости или ткани организма) судят по силе производимого ими действия. По активности фермента можно вести и приблизительный учет его количества.
Рассмотрим отдельные группы веществ, входящих в кровь. Обратим внимание в первую очередь на белки, составляющие важнейшую и неотъемлемую часть всякой живой ткани, в том числе и крови.
Белки - самые важные составные части крови. К ним относится гемоглобин крови, который содержится в эритроцитах у всех позвоночных животных и человека. Кровь здорового человека содержит от 13 до 16% гемоглобина. Цифра эта многим читателям может показаться странной, так как в анализах крови обычно указывается: содержание гемоглобина 65-80%. Но дело в том, что в медицинской практике за 100 принимают содержание гемоглобина, равное 16,7 г в 100 мл крови. В крови здорового взрослого человека содержится несколько меньше гемоглобина - не 100, а 60-80%. Следовательно, заключение лаборатории "гемоглобина - 80% (правильнее отмечать - 80 единиц) означает, что кровь содержит 80% от 16,7 г, т. е. около 13,4 г гемоглобина в 100 мл крови.
У женщин и детей до 10 лет уровень гемоглобина в крови несколько ниже. Впрочем, даже у одного и того же человека содержание гемоглобина в крови может меняться на протяжении суток: утром кровь немного богаче этим пигментом, чем вечером.
Врачи недаром тщательно следят за содержанием гемоглобина в крови. Жизнь человека без дыхания невозможна, а гемоглобин выполняет роль переносчика кислорода из легких в ткани и участвует в переносе углекислого газа из тканей в легкие (поэтому он и получил название дыхательного пигмента).
Конечно, кровь могла бы переносить кислород просто в растворенном виде, не связав его с гемоглобином, но в таких небольших количествах, что ткани просто задохнулись бы от недостатка кислорода. Поэтому очень важно поддерживать уровень гемоглобина в крови на должной высоте.
Гемоглобин легко соединяется с кислородом, образуя непрочное соединение - оксигемоглобин, который также легко отдает этот кислород. К сожалению, гемоглобин "неразборчив" в своих связях. Так, например, он очень прочно (прочнее, чем с кислородом) связывается с окисью углерода - угарным газом. Если человек вдыхает большие количества этого газа, гемоглобин оказывается связанным и его уже не хватает, чтобы обеспечить органы нормальным количеством жизненно необходимого кислорода.
Окись углерода содержится в горючем газе, широко применяемом в быту. Это и определяет возможность отравления газом при неправильном пользовании. Повышенное содержание окиси углерода в бытовом газе тоже грозит тяжелыми последствиями. В Риме только за 1960 г. отмечено несколько десятков случаев гибели иногда целых семейств только из-за того, что фирма, захватившая в свои руки снабжение газом, не пожелала произвести мизерные затраты на приспособления, снижающие содержание окиси углерода в бытовом газе, и тем самым уменьшить его ядовитость. "Молчаливая смерть" - окрестили итальянцы несчастные случаи с людьми, подвергшимися действию такого газа.
Итак, роль гемоглобина крови исключительно велика. Изменения в количественном содержании гемоглобина или в его строении, конечно, небезразличны для здоровья. Уменьшение количества гемоглобина характерно для анемии - малокровия. Оно может быть следствием значительной потери крови или недостаточного образования гемоглобина в организме. Важным признаком некоторых заболеваний служит выход гемоглобина из эритроцитов в плазму крови (гемоглобинемия). Что же предпринять, если в крови гемоглобина недостаточно?
Имеется много способов, которые может указать врач. Пожалуй, самый популярный из них - поездка в горы. Оказывается, в разреженной атмосфере скорость образования гемоглобина резко повышается. Это легко понять: когда организм начинает испытывать недостаток кислорода (а в разреженном воздухе его мало), наш организм мобилизует все возможности, чтобы компенсировать недостаток и производит больше гемоглобина.
Однако на слишком больших высотах, где воздух разрежен, у большинства нетренированных людей могут появиться признаки горной болезни - удушье, головокружение, слабость и т. д. Поэтому "добывать" гемоглобин целесообразно на высотах 1000-1500 м над уровнем моря. Гемоглобин повышается в этих условиях, хотя и более медленным темпом, зато не в ущерб здоровью.
Изменения в содержании гемоглобина при подъеме в горы - наглядный пример того, как химизм крови приспосабливается к новым, непривычным для нашего организма условиям.
Гемоглобин содержится только в эритроцитах крови. Поэтому количество его зависит от числа эритроцитов. Однако эритроциты при различных обстоятельствах могут быть беднее или богаче гемоглобином. Когда в силу определенных причин образование эритроцитов в нашем теле (они образуются в костном мозге) принимает авральный характер, например после потери крови, может появиться некачественная продукция: костный мозг выбрасывает в кровь обедненные гемоглобином эритроциты. Поэтому врачи не довольствуются определением общего содержания гемоглобина. Они учитывают и степень насыщенности отдельных эритроцитов этим пигментом, пользуясь так называемым цветным показателем. У вполне здоровых людей этот показатель бывает равен единице.
Установлено, что потеря небольших количеств крови (не свыше 450 г) не приносит здоровью человека никакого вреда. Процессы кроветворения и кроворазрушения в организме хорошо сбалансированы. Проходят всего сутки после взятия крови, и в кровеносной системе донора уже восстанавливается общее количество крови за счет тех ее запасов, которые хранились в депо - в печени и селезенке, а также за счет межтканевой жидкости, перешедшей в кровеносные сосуды.
Медленней восстанавливается состав крови. Вместе с кровью при кровопускании уходят ее живые клетки - эритроциты, лейкоциты, тромбоциты. Кроме того, потеря крови вызывает гибель части эритроцитов, оставшихся в кровяном русле донора. С этим связано и падение гемоглобина. Но вот костный мозг начинает усиленно работать, и лабораторные анализы показывают, что в крови появилось много молодых красных кровяных телец - ре-тикулоцитов. Постепенно они превращаются в зрелые эритроциты. Процесс заканчивается в разные сроки - от 14 до 25 дней - в зависимости от количества взятой у донора крови. Эти данные помогли установить правильную дозировку и сроки взятия крови у доноров.
Принято считать, что причиной смерти при большой потере крови является кислородное голодание. Это как будто логично: ведь в кровяном русле уменьшается количество эритроцитов - переносчиков кислорода. На самом же деле в большинстве случаев смерть наступает вследствие резкого падения кровяного давления в сосудах, так как жизненно важные органы плохо снабжаются кровью. Достаточно поддержать давление крови на необходимом уровне - и человек будет спасен. Костный мозг начинает усиленно работать, порождая каждую секунду 10 млн. эритроцитов. В таких случаях достаточно ввести в сосуды раненого плазму крови или кровезаменитель - жидкость, которая восстанавливает общую массу крови, и давление повышается. Ныне создано немало таких препаратов: коллоидный инфузин, поливинил, пирролидон, полиглюкин и др.
Какова дальнейшая судьба крови, перелитой человеку? Эритроцит в кровяном русле разрушается, распадаясь на белковую часть - глобин и на красящее вещество - гем. От молекулы гема отделяется окись железа. Организм не может синтезировать железо и получает его с пищей. Железо необходимо для построения новых молекул гемоглобина, поэтому организм обращается с этим элементом очень экономно и возвращает его клеткам костного мозга. От гема остается еще желчный пигмент билирубин. Часть пигмента выводится из организма, часть снова поступает в кровь. По количеству билирубина можно судить о судьбе эритроцитов в организме.
Свертывание крови - сложный процесс, протекающий пофазно. В первой фазе из кровяных пластинок (один из видов клеток крови), обладающих способностью склеиваться друг с другом и образовывать тромб, идет выделение тромбопластина (от греческих слов "тромбос" - ком или сгусток и "пластин" - создаю, образую). Тромбы образуются в кровяном русле в силу болезненных причин, когда способность кровяных пластинок склеиваться усиливается. Вторая фаза - превращение белкового вещества крови протромбина под воздействием выделившегося тромбопластина в активный фермент - тромбин. В третьей фазе идет процесс свертывания крови: происходит превращение другого белка крови фибриногена в нерастворимый фибрин под влиянием тромбина. Из нитей и сгустков фибрина создается основа тромба, закупоривающего сосуд.
В крови, как правило, готового тромбина нет. У здорового человека в ответ на появление небольших количеств тромбина сразу возникает защитная реакция. С помощью специального рефлекса организм защищает себя от тромбина: в кровь поступают противосвертывающие вещества - гепарин (от греческого слова "гепар" - печень). Больше всего гепарина в тканях печени и легких.
Пока в организме сохраняется противосвертывающий рефлекс, небольшие количества тромбина не вызывают свертывания крови. При атеросклерозе, характеризующемся, как известно, изменением стенок сосудов, чувствительность к тромбину нередко снижена. Вследствие этого защитный рефлекс не возникает. Противосвертывающие вещества не выделяются, возможность образования тромбов увеличивается.
Мы рассказали о процессе свертывания крови в общих чертах*. На этот процесс влияют и другие факторы, как, например, атеросклеротическое изменение сосудов, ослабление сердечной деятельности и связанное с этим замедление тока крови. Однако при изучении интенсивности процесса свертывания крови в лабораториях, как правило, учитывается только протромбин. Этого показателя достаточно, чтобы приблизительно судить об интенсивности процесса свертывания крови.
*(Свертывание крови мы рассмотрим более подробно в дальнейшем.)
Если протромбина в крови мало, врачи назначают викасол (витамин К), улучшающий свертываемость крови. В случае же повышенных количеств протромбина применяются специальные вещества, так называемые антикоагулянты: гепарин, дикумарин, неодикумарин, пелентан, фенилин, фибринолизин. Однако применение антикоагулянтов без указания и наблюдения врача недопустимо. Оно требует повторных анализов крови на содержание протромбина, так как при резком его снижении могут возникнуть серьезные кровотечения, ранние признаки которых устанавливаются по появлению красных кровяных шариков в моче.
Антикоагулянты кроме основного своего действия - влияние на свертываемость крови - уменьшают боли в области сердца при инфаркте. Антикоагулянты предупреждают приступы стенокардии после инфаркта и возможность повторенпя инфаркта.
Большое значение имеют белки кровяной плазмы. Известно более 100 различных белков плазмы, но выделено пока не более 30. Естественно, что сыворотка содержит те же белки (кроме фибриногена, выпадающего в осадок при свертывании крови). Большая часть этих белков синтезируется в печени.
Белки плазмы влияют на водный обмен между кровью и тканями тела: как только содержание их в плазме уменьшается, вода переходит из кровеносных сосудов в ткани (обычно стенки сосудов почти непроницаемы для крупных частиц белка).
Белки плазмы принимают участие в обмене белков всего организма. Они представляют собой своего рода исходный материал для построения специфических белков различных тканей. Они поддерживают нормальное кровяное давление, обеспечивают однородность крови как жидкости, защищают организм от вредных бактерий и "чужеродных" веществ.
Белки, содержащиеся в плазме, как зеркало, отражают состояние всего белкового хозяйства организма. Теряет ли организм большие количества белков (при кровотечениях, ожогах, лихорадочных состояниях), получает ли их извне в недостаточном количестве (потеря аппетита, расстройство кишечника, голодание) или, наконец, утрачивает ли способность синтезировать (при болезнях печени, почек и др.) - содержание белков в плазме крови уменьшается, и это нетрудно обнаружить при анализе. Врачи говорят в таком случае о гипопротеинемии, которая является показателем многих болезненных состояний. Можно считать, что уменьшение общего количества сывороточных белков на 1 г свидетельствует о потере организмом около 30 г тканевых белков.
Гораздо реже встречается повышенное содержание белков в плазме - гиперпротеинемия, которая тоже отражает изменения, происходящие в тканях организма уже при других болезнях.
В последние годы медицина не довольствуется определением общего количества белков плазмы. Она делает успешные попытки заглянуть глубже, познакомиться с качественным составом этих белков.
Химики давно уже сомневались в однородности белков плазмы. Ведь и о многих других белках, считавшихся ранее однородными, стало известно, что они состоят из разных белков. Так, яичный белок (давший свое название всем белкам) оказался смесью, в которую входят не менее десяти различных белков. В состав белка молока, сыра, творога, называемого казеином, тоже входит не менее четырех различных белков.
Для разделения белков, в том числе и белков плазмы крови, пользуются электрофорезом. Метод основан на том, что молекулы белков в растворе несут электрические заряды. Если через раствор пропускать электрический ток, поместив в него электроды, то молекулы в соответствии со своими зарядами будут двигаться к электродам.
Представим себе скачки: лошади несутся по полю, сначала все вместе, затем постепенно растягиваются, и к финишу раньше прибывает та, которая развила наибольшую скорость. Электрофорез - такие же своеобразные скачки молекул. Под действием электрического тока молекулы различных белков перемещаются с различной скоростью. Пользуясь этим, можно разделять смесь белков на отдельные фракции.
Известно несколько электрофоретических фракций белков кровяной плазмы. Они получили название альбуминов и глобулинов, причем различают еще альфа-, бета-и гамма-глобулины. Фибриноген - белок, обусловливающий свертывание крови, - также относится к глобулинам. Таким образом, были исследованы белки крови почти всех животных. Различия в электрофоретических фракциях оказались настолько характерными, что, пользуясь ими, можно даже установить вид животного, у которого была взята кровь.
Очень важно и то обстоятельство, что электрофорети-ческие фракции белков крови хорошо отражают изменения в состоянии животного организма, работе его органов, обмене веществ и т. д. Понятно, почему белковые фракции сыворотки крови животных, побывавших в космосе, представляют большой интерес для науки.
Изучение фракций белков плазмы крови позволяет врачу уточнить характер болезни и следить за ее развитием. Так, например, повышение содержания альфа-глобулинов у больного туберкулезом позволяет обнаружить очередную вспышку процесса. Для некоторых болезней почек очень характерно повышенное содержание альфа-и бета-глобулинов при одновременном снижении количества гамма-глобулинов и альбуминов. Изменение фракций белков крови особенно важно при болезнях печени, так как позволяет определить болезнь и характер лечения.
При некоторых заболеваниях в крови появляются (иногда в значительных количествах) совершенно особые белки, характерные для определенной болезни, например миеломный белок при миеломе (опухоли костного мозга). Изучение белковых фракций сыворотки крови позволяет также судить о работе многих органов и прежде всего о защитных силах организма. Когда в кровь попадают чужеродные крупные белковые молекулы, реже полисахаридные, кровь тотчас же мобилизует все химические ресурсы для борьбы с такими пришельцами - антигенами*.
*(Антигенными свойствами обладают все белки, а также некоторые полисахариды и вещества смешанной природы. Антигенами могут быть живые тела (например, болезнетворные бактерии) и определенные химические вещества, находящиеся в растворенном состоянии. Наконец в определенных условиях в роли антигенов могут выступать собственные белки, и тогда в организме вспыхивает "междоусобная война".)
Защищая организм от нашествия антигенов, кровь вырабатывает особые белковые тела - антитела (противотела), которые нападают на пришельцев и обезвреживают их, вступая с ними в реакции самого различного характера. Но иногда такие реакции протекают настолько бурно, что вызывают гибель организма. Это может произойти, например, если в кровь человека неоднократно вводится чужеродная кровь или сыворотка. В этом случае может возникнуть так называемый анафилактический шок (от греческого слова "ана" - против и "филаксис" - защита). Опасность шока всегда строго учитывается при переливаниях крови и введении лечебных сывороток.
Чаще же реакции антител с антигенами вызывают повышение температуры, различные воспалительные явления (аллергические). В результате антигены быстро блокируются и обезвреживаются.
Так или иначе антитела - хорошие защитники нашего организма. Все антитела - белки, относящиеся к группе глобулинов, главным образом гамма-глобулинов. Поэтому гамма-глобулины нашли сейчас широкое применение как лечебные препараты, укрепляющие защитные силы организма.
В силу своей белковой природы антитела для чужой крови являются антигенами и вызывают в ней появление соответствующих антител. После того как в кровь попал антиген, новообразование антител (их синтез происходит в лимфатических клетках организма) идет постепенно, но с необычайной скоростью: на каждую молекулу антигена приходятся десятки, иногда сотни тысяч молекул антител.
Антитела - белки, и, если белковые запасы организма истощены (например, при недостаточном и неполноценном питании), наш организм не в состоянии отвечать на раздражение антигеном обильным образованием антител. Вот почему инфекционное заболевание, связанное с внедрением в организм болезнетворных бактерий (антигенов), обычно сопровождающееся высокой температурой, иногда протекает без повышения температуры.
Из всего сказанного ясно, что изучение антител и количественное определение их в сыворотке крови больного приобретает все большее и большее значение в медицине. Если глобулины кровяной сыворотки принимают участие в защите организма в качестве антител, то защитная роль сывороточных альбуминов выражается в их способности связывать ядовитые вещества - токсины.
Некоторые глобулины тоже обладают антитоксическими свойствами: они обезвреживают токсины, выделяемые возбудителями дифтерии, столбняка и других грозных врагов человека.
В настоящее время многие антитоксины получают из крови специально подготовленных животных. Их применяют для борьбы с различными болезнетворными микробами. Достаточно напомнить о противодифтерийной сыворотке или об антитоксических сыворотках против различных ядов, например змеиного.
Ученым уже давно известна способность сыворотки крови убивать бактерии и обезвреживать вирусы. В этом отношении особенно активен открытый недавно белок - пропердин, который также входит в состав глобулиновой фракции белков сыворотки крови. Различные фракции белков крови представляют значительный интерес еще и потому, что к ним относятся многие ферменты, - пожалуй, самые важные вещества нашего тела. Но о ферментах крови мы подробно расскажем ниже.
В последнее время внимание ученых привлекли некоторые сложные белки крови, в состав которых, кроме аминокислот, входят еще и другие безазотистые вещества, например сахара или их производные. Такие белки называют глюкопротеидами. Хотя все они играют важную роль в организме, наибольший интерес вызывает содержащийся в сыворотке крови мукоид. Внимание врачей привлекло то обстоятельство, что количество этого вещества в крови меняется при различных состояниях организма и в связи с этим его содержание в крови может служить диагностическим признаком. Изменения в содержании сывороточного мукоида изучались нашими учеными у подопытных животных, совершивших знаменитое путешествие на борту второго корабля-спутника.
Липопротеиды - сложные соединения белков с жиро-подобными веществами липоидами - в последние годы также интересуют врачей как показатели некоторых болезненных состояний организма. Соединяясь с нерастворимыми в воде липоидами, белки делают их растворимыми и облегчают перенос липоидов током крови. Такого рода транспортные функции выполняются и другими белками, переносящими железо, цинк, медь и другие вещества*.
*(При некоторых болезнях, сопровождающихся воспалением или гибелью тканей, в сыворотке крови появляется так называемый С-реактивный белок (название указывает на его способность вступать в реакцию с С-полисахаридом пневмококков).)
Если из плазмы и сыворотки крови удалить белки, то в растворе останется большое количество веществ небелковой природы, содержащих азот. Они объединяются в группу азотсодержащих небелковых веществ. Из веществ этой группы прежде всего следует назвать аминокислоты. Аминокислоты, которые еще не "встроены" в Частицу белка, называют свободными. Они попадают в кровь главным образом из кишечника, где образуются в результате расщепления пищевых белков соответствующими ферментами. Кровь разносит свободные аминокислоты по всем органам и тканям, которые их используют для построения собственных белков и для других превращений. Эти же органы и ткани отдают в кровь те свободные аминокислоты, которые образуются при распаде тканевых белков. Таким образом, кровь постоянно транспортирует аминокислоты и содержание их в крови поддерживается обычно на относительно постоянном уровне. Большая часть аминокислот содержится в эритроцитах, меньшая - в жидкой части крови - плазме.
Содержание аминокислот в крови принято выражать в мг% аминоазота. В норме эритроциты содержат около 10 мг%, а плазма - около 6 мг% аминоазота.
Зная нормальный уровень аминокислот в крови, можно следить за его изменениями, а это говорит врачу о многом. Прежде всего эти данные позволяют судить о работоспособности печени и почек. Печень - главная химическая лаборатория нашего тела. Кровь доставляет в нее аминокислоты из кишечника. Из этих "пищевых" аминокислот печень строит белки не только для себя, но и для той же самой крови. Часть аминокислот печень подвергает различным превращениям, например отнимает содержащую азот аминогруппу (дезаминирует), а азот использует для построения конечного продукта обмена белков - мочевины. Кровь доставляет ее к почкам, которые выводят мочевину с мочой наружу.
Теперь понятно, почему содержание аминокислот в крови позволяет судить о работе печени и почек. Нужно ли добавлять, что при всех заболеваниях, связанных с повышенным распадом белков (лихорадочные состояния, болезни сердца, истощение, рак и т. д.), кровь как бы наводняется продуктами этого распада - аминокислотами.
Врача интересует, конечно, не только общее количество аминокислот в крови, но и их состав. В состав белков нашего тела входит более 20 разных аминокислот, и все они, как правило, присутствуют в крови. Трудно сказать, какие из этих аминокислот поступили из белков пищи, какие образовались при распаде белков в тканях нашего тела. Отметим только, что почти одна треть общего количества аминокислот плазмы падает на долю так называемой глютаминовой кислоты, а это, пожалуй, самая важная из всех аминокислот.
Эта аминокислота занимает центральное положение в обмене азотистых веществ в организме. В печени она образуется раньше и быстрее остальных аминокислот и выполняет п организме самые разнообразные функции. Особую роль глютаминовая кислота играет в обмене веществ мозга. Достаточно сказать, что эта кислота - единственное вещество (помимо глюкозы), которое интенсивно окисляется ферментами мозга. Кроме того, эта аминокислота обладает замечательной способностью связывать и обезвреживать аммиак, являющийся сильным ядом для нервной ткани.
Немаловажную роль в нашем теле играют и другие аминокислоты. Большое значение при этом имеет их количественное соотношение в крови. Новейшие методы (хроматографический и другие) дают возможность определять раздельно все аминокислоты крови, и этим с успехом пользуются врачи. Особенно ценные результаты они получают, сопоставляя содержание различных аминокислот в крови и в моче, так как химический состав мочи отражает даже небольшие сдвиги в химизме крови.
Около половины всех небелковых азотистых веществ крови составляет мочевина. Как мы уже говорили, она образуется в основном в печени, откуда поступает в кровь. Последняя разносит мочевину в ткани и выводит ее из организма главным образом через почки.
Нормальная кровь содержит от 1 до 20 мг% азота мочевины. Анализ проводят натощак, так как после приема белковой пищи уровень мочевины в крови может резко повыситься. Если повышенное содержание мочевины в крови держится длительное время - это грозный признак, чаще всего свидетельствующий о плохой выделительной работе почек. Причиной увеличения мочевины в крови может служить и повышенный распад тканевых белков при заболевании. Сама мочевина довольно безвредна, но повышение ее содержания в крови сопровождается накоплением других ядовитых продуктов обмена. Поэтому уремия (от латинского "уреа" - мочевина), правильнее гиперуремия, настораживает врача в его борьбе за жизнь больного.
Для правильного лечения больных подагрой и ревматизмом немалое значение имеет определение в крови другого азотистого вещества - мочевой кислоты. Нормальная кровь не богата этой кислотой (около 3 мг%), но при подагре, особенно перед приступом болей, содержание моченой кислоты в крови может удвоиться.
Кровь содержит небольшие количества еще нескольких азотистых веществ. Среди них креатин и креатинин, повышенное содержание которых может свидетельствовать о слабой работе печени; билирубин, увеличение которого свидетельствует о болезни печени и о повышенном распаде гемоглобина; аммиак, в очень небольшом количестве образующийся в тканях. При усилении в кишечнике гнилостных процессов в кровь поступает повышенное количество индикана и индоксила, которые можно рассматривать как обломки молекулы одной из аминокислот - триптофана.
Проводить количественное определение азотистых веществ в крови трудно, поэтому на практике нередко довольствуются определением так называемого остаточного азота, т. е. азота всех небелковых веществ крови (правильнее называть его небелковым азотом). В норме кровь содержит 25-35 мг% остаточного азота. Содержание его может увеличиваться при болезнях сердца, отравлениях и некоторых инфекционных болезнях.
В состав крови входят еще несколько азотистых соединений. Наиболее важное из них - лецитин.
Из нескольких углеводов, присутствующих в крови, наибольшее внимание медиков привлекает виноградный сахар - глюкоза. Достаточно сказать, что если в норме содержание глюкозы в крови составляет 100 мг%, то при сахарной болезни оно может увеличиться до 600 мг%. Определение сахара в крови при этом заболевании имеет огромное значение: оно позволяет установить заболевание даже тогда, когда человек чувствует себя здоровым, дает возможность контролировать состояние больного во время лечения, помогает предсказать ход заболевания.
Уровень глюкозы в крови (гликемия) может значительно, но кратковременно меняться и в обычных физиологических условиях. Достаточно принять с пищей большое количество сахара (больше 100 г), и содержание глюкозы в крови не только повысится (гипергликемия), но и перейдет в мочу (глюкозурия).
Если вы болельщик, то знайте, что во время матча команд "Спартак" и "Динамо" не только у вас, но и у тысяч других зрителей содержание глюкозы в крови подскакивает далеко за пределы нормы. И только у равнодушных наблюдателей (найдутся ли такие на стадионе?) оно останется без заметных изменений. Таким образом, и возбуждение нервной системы может повысить уровень сахара в крови. То же явление можно наблюдать при усиленной мышечной работе. Но во всех этих случаях гипергликемия носит скоропреходящий характер.
При сахарной болезни и ряде других болезней гипергликемия длится долго и ее колебания позволяют следить за состоянием больного. Определение сахара в крови дает более надежные цифры для суждения о ходе болезни, чем определение сахара в моче. Особенно наглядные результаты получаются, если больному дать 50-100 г глюкозы, а затем определить содержание ее в крови через определенные промежутки времени. Результаты, полученные после такой сахарной нагрузки, выражают в виде кривой, характер которой многое может сказать врачу. Очень часто вместо глюкозы дают нагрузку другими сахарами - фруктозой, галактозой, что позволяет оценить работу печени. (Эти сахара потребляются почти исключительно печенью.)
"Сахарные пробы", или сахарные кривые, излюбленный метод биохимического исследования в клиниках всех специальностей, но особенно терапевтических. Они применяются для изучения углеводного обмена и переносимости (толерантности) к углеводам. У здорового человека максимальный подъем сахарной кривой наблюдается через 30 мин. после приема глюкозы. В моче сахар совсем не появляется или появляется на короткое время в период наибольшего подъема уровня сахара в крови. "Порог выделения" равен 160-180 мг%. Через 2-2,5 часа сахарная кривая снижается до нормы.
В почечных канальцах происходит всасывание глюкозы "обратно" в кровь. При нарушении этого всасывания глюкозы в почечных канальцах сахар выделяется с мочой при более низком содержании его в крови. Сахарная кривая в этом случае может не отличаться от кривой здорового человека, но продолжительность глюкозурии однако увеличена. Так обнаруживается почечный диабет.
При подозрении на сахарный диабет делают двойную сахарную нагрузку, которая заключается в том, что спустя полтора - два часа после первого приема 50 г глюкозы больному дают вторично такую же порцию глюкозы. Если деятельность поджелудочной железы не нарушена, вторая порция глюкозы не вызывает вторичного повышения сахарной кривой. При недостаточности инсулярного аппарата после второй порции глюкозы происходит новый подъем кривой с очень медленным снижением.
Гораздо реже встречаются состояния гипогликемии - понижения нормального уровня сахара в крови. Бывают люди, подверженные внезапным обморокам и неопределенным болям. Если такие больные успевают вовремя принять кусок сахара, часто удается предотвратить обморок и успокоить боли. Определение сахара в крови позволяет установить у таких больных гипогликемию. Тяжелая гипогликемия - грозный признак некоторых заболеваний, к счастью, встречающихся редко. Легкая гипогликемия - но ниже 60-70 мг% глюкозы в крови - встречается довольно часто и угрозы не представляет.
Каким же образом здоровый организм регулирует постоянство содержания сахара в крови и почему оно может нарушаться?
Еще в середине XIX в. известный французский физиолог Клод Бернар сделал ряд очень интересных опытов. Ученый установил, что укол в один из участков Мозга кролика вызывает у животного интенсивный переход гликогена - животного крахмала, накапливающегося в печени, в сахар, а вследствие этого уровень сахара в крови повышается. Оказалось, что "сахарный укол", как его назвали впоследствии, вызывает переход гликогена в сахар двумя способами. Во-первых, непосредственным воздействием на клетки печени через нервные волокна, а во-вторых, нервным возбуждением желез внутренней секреции - надпочечников, которые в этом случае начинают усиленно выделять в кровь гормон адреналин. Адреналин, поступив в печень с кровью, в свою очередь способствует превращению гликогена в сахар.
Инсулин - гормон поджелудочной железы - в противоположность адреналину способствует превращению сахара крови в гликоген печени. Выделение инсулина и адреналина регулируется центральной нервной системой. Поэтому-то эмоциональное возбуждение, как правило, сопровождающееся усиленным выделением в кровь адреналина, ведет к повышению в ней уровня сахара.
Тщательные научные наблюдения показали, что из всех углеводов, содержащихся в пище, только моносахариды (т. е. простые сахара) быстро всасываются из кишечника в кровь и, следовательно, сразу могут быть использованы организмом. Сложные сахара - дисахариды, а тем более полисахариды - должны предварительно подвергнуться расщеплению в пищеварительном аппарате. Только после того, как они распадутся на моносахариды, их могут использовать клетки организма.
Может быть, целесообразно питаться одними моносахаридами, например глюкозой? Такое предположение неверно. Установлено, что при избыточном количестве моносахаридов, съеденном в течение короткого времени, организм человека не успевает полностью использовать его. Избыток моносахаридов окисляется, а выделяющееся при этом излишнее тепло бесполезно уходит в окружающее пространство. Полисахариды же, поступающие с пищей, перевариваются медленнее, постепенно распадаясь в течение нескольких часов на молекулы моносахаридов и всасываясь в кровь, благодаря чему используются целиком. Из полисахаридов в небольшом количестве (5 мг%) в крови встречается гликоген, который сконцентрирован в лейкоцитах. Часть Сахаров в крови связана с белками (глюкопротеиды, о которых мы говорили выше). Остановимся на одном наследственном нарушении обмена углеводов - галактоземии, которое особенно характерно проявляется в крови. (Об ошибках обмена углеводов речь шла в других разделах этой книги.) Галактоземия - повышенное содержание галактозы в крови. Но это только буквальный перевод термина, которым обозначают наследственную болезнь, главным образом у детей. Болезнь эта проявляется увеличением содержания галактозы в крови (гипергалактоземия), выделением этого сахара в моче (галактозурия), выделением аминокислот и белков с мочой. В дальнейшем отмечается истощение, замедленное развитие ребенка, сильное увеличение размеров печени и селезенки и последующий цирроз печени, катаракта глаз и слабоумие.
Наследственная галактоземия, которую можно назвать "галактозным диабетом" (она сопровождается повышенным выделением галактозы с мочой - галактозурией), довольно редкое заболевание. Открыто оно сравнительно недавно. Около 60 лет назад один немецкий врач обратил внимание на восьмимесячного ребенка в состоянии резкого истощения, с сильно увеличенной печенью, выделявшего с мочой сахар. После отнятия от груди, младенец, не получая молока, перестал выделять сахар, но все же погиб. Вскрытие показало резко выраженный цирроз печени. Так как родители давали ребенку коньяк, вредивший печени, врач не связал наблюдавшееся им прекращение выделения сахара в моче с отнятием младенца от груди, т. е. с лишением его молока. Через 20 лет было сделано другое наблюдение: четверо братьев и сестер в одной семье выделяли сахар в моче, пока получали грудное молоко. Постепенно картина стала уточняться, и десять лет назад было отмечено около 50 случаев галактоземии. За последнее десятилетие цифра эта удвоилась. Удалось проследить за галактоземией в четырех поколениях одной семьи, затем в трех родственных семьях, затем в 13 семьях и т. д., а главное - полностью выяснить биохимические основы этой болезни.
Молоко матери содержит галактозу в составе молочного сахара - лактозы (рис. 42). Откуда берется эта галактоза? Известно, что галактоза и глюкоза - химически близкие соединения. Источником галактозы для молочного сахара является глюкоза, содержащаяся в крови матери. Несмотря на большое сходство строения глюкозы и галактозы, они превращаются одна в другую при помощи целой системы ферментов, о которых речь пойдет ниже. Образовавшаяся лактоза, попадая вместе с молоком в желудочно-кишечный тракт, проходит его сначала "нетронутой", и только в кишечнике лактаза расщепляет ее на две молекулы глюкозы и галактозы. Вместе с глюкозой галактоза всасывается из кишечника в кровь и доставляется в печень, где превращается в главное топливо организма - глюкозу. Вот здесь и удалось открыть ошибку обмена веществ, влекущую возникновение болезни.
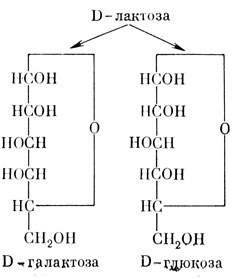
Рис. 42. Молекулы D-лактозы, состоящие из D-галактозы и D-глюкозы
Что же происходит при этом?
Начинается процесс с присоединения к галактозе одной молекулы фосфорной кислоты за счет АТФ. Эту реакцию ускоряет фермент галактокиназа, в результате чего образуется галактозо-1-фосфат. Затем в реакцию вступает глюкоза, которая предварительно соединяется с уридином (составная часть рибонуклеиновой кислоты) и фосфорной кислотой, образуя уридиндифосфат-глюкозу. Последняя под воздействием специального фермента - галактотрансферазы обменивается с галактозой с образованием га-лактозо-1-фосфата, в результате чего глюкоза выходит из реакции в виде глюкозо-1-фосфата. Именно в таком виде она активируется и способна к дальнейшим превращениям. А галактоза, ставшая уридипдифосфатгалактозой, подвергается воздействию фермента эпимеразы, специфической особенностью которого является ускорение перемещения атомов внутри молекулы (эпимеризация), и превращается в уридиндифосфат-глюкозу. На эту последнюю действует фосфорная кислота (реакцию ускоряет фермент пирофосфат-фосфорилаза), в результате чего образуется глюкозо-1-фосфат, который используется в обмене веществ. Тут же образуется и уридинтрифосфат. Теперь уже можно совершенно точно указать, где происходит ошибка. В клетке не синтезируется молекула белка-фермента галактотрансферазы или же допускается отклонение, приводящее к резкому понижению активности этого фермента.
Можно ли защитить ребенка, родившегося от больных галактоземией, от вредного действия галактозы из лактозы молока, увеличения и цирроза печени, появления катаракты на глазах, слабоумия? Давно уже было известно, что галактозу в некоторой степени можно считать ядовитым сахаром. Если давать цыплятам галактозу, то у них начинаются судороги (поражение мозга), а у крыс этот сахар вызывает катаракту на глазах. То же наблюдается и у детей, больных галактоземией. И повреждения печени можно вызвать у животных с помощью галактозы, хотя и не с тем постоянством, как это наблюдается у больных детей. Правда, у новорожденных печень еще не работает в полную силу, функции ее еще несовершенны, и этим можно частично объяснить то обстоятельство, что прием галактозы у детей влечет ненормаль-Ное повышение этого сахара в крови и выделение в моче, тогда как взрослые переносят нагрузку галактозой легче.
Но все же поводов для заключения о ядовитости галактозы достаточно: возможно, что она объясняется изменением проницаемости тканей под влиянием этого сахара. Действительно, достаточно ввести галактозу крысам внутривенно, как через несколько минут начинает возникать катаракта глаз. С другой стороны, был подмечен антагонизм между глюкозой и галактозой: достаточно ввести в организм галактозу, как уровень глюкозы в крови начинает снижаться, а уровень галактозы повышаться. Можно предположить, что галактоза служит причиной относительного глюкозного голодания, что и обусловливает ее ядовитость.
Удалось вырастить такую культуру кишечной палочки, которая из-за отсутствия специфических ферментов была лишена возможности метаболизировать, т. е. подвергать галактозу химическим превращениям. К культуре, лишенной фермента галактокиназы, добавили галактозу, но это не отразилось на росте микробов. Когда же галактозу прибавили к культуре микробов, лишенных трансферазы, рост микробов остановился и, что самое интересное, в микробных клетках накопился галактозо-1-фосфат. Отсюда вывод: ядовитое действие оказывает не сама галактоза, а ее активированная форма: галактозо-1-фосфат. Каким образом это может происходить?
Предположений здесь несколько. Галактозо-1-фосфат может служить как бы ловушкой для фосфорной кислоты и тем самым уменьшить ее запасы. А соединение с фосфорной кислотой - начало всех химических превращений глюкозы. Галактоза может отнимать фосфорную кислоту (фосфат) у АТФ. И, наконец, галактозо-1-фосфат может оказывать тормозящее действие на ряд ферментов, участвующих в превращениях глюкозы, а это, естественно, может дезорганизовать использование глюкозы, и в частности уменьшить количество глюкозы, переходящей из печени в кровь.
С накоплением галактозо-1-фосфата в клетках организма можно бороться. Предварительные результаты указывают, например, что один из стероидных гормонов - прогестерон - способствует нормализации превращений галактозы у больных галактоземией, что такое же действие может оказать и обыкновенный ментол. Но все это пока предположения. Единственно верный способ лечения - устранение галактозы (и её источника - молочного сахара) из питания больных. Интересно, что с возрастом человек начинает лучше переносить галактозу. У взрослых людей печень становится полноценной и функционирует лучше. У грудных младенцев печень еще несовершенна. Тем важнее уметь с первых же дней, даже и часов жизни новорожденного открыть возможную ошибку обмена. Это позволит с первых же дней жизни ребенка перевести его на диету, лишенную молочного сахара, и тем самым избежать тяжелых последствий обычного питания (молоко категорически противопоказано).
Еще недавно диагноз болезни ставили только на основании перенесения больным ребенком добавочной (кроме получаемой с молоком) порции галактозы, а этот способ далеко не безопасен. Современная медицина ставит диагноз уже в первые часы жизни младенца, определяя активность специфического фермента в эритроцитах.
Галактоземия и галактозурия могут быть не только врожденными, но и благоприобретенными. Поскольку нарушения обмена галактозы в основном происходят в печени, можно ожидать, что при некоторых повреждениях печени создаются условия, затрагивающие ту систему ферментов, которая ведает превращениями галактозы. У взрослых диагноз может быть установлен после нагрузки галактозой, на которую люди с больной печенью реагируют совершенно иначе, чем здоровые люди. Маленькие дети отвечают на нагрузку галактозой так, как взрослые с больной печенью. Несовершенство детской печени необходимо всегда иметь в виду при подозрении на врожденную галактоземию.
Интересно, что больные галактоземией выделяют резко повышенное количество аминокислот в моче. По некоторым данным, причиной этого явления служит недостаток в работе почек, возможно врожденный (и здесь ошибка обмена веществ) или обусловленный "ядовитостью" галактозо-1-фосфата, изменяющей проницаемость почек. Среди аминокислот преобладают глицин, аланин, треонин. Все они сравнительно простого строения. Интересно, что аминокислоты в моче появляются только тогда, когда ребенок получает галактозу, и в течение 7 дней после прекращения приема этого сахара.
Ученые считают, что галактоземия обусловлена единичным аутосомным геном. Совсем недавно были проведены исследования, показавшие, что при галактоземии происходит полная блокировка галактозы-1-фосфата при почти полном отсутствии уридиндифосфатгалактозы.
Давно уже замечено, что атеросклероз - заболевание, при котором на стенках кровеносных сосудов откладывается холестерин и сосуды делаются малоэластичными, хрупкими, - очень редко поражает жителей Италии, Греции и побережья Ледовитого океана. Оказалось, что невосприимчивость к атеросклерозу у этих народов вызвана общей причиной. Дело в том, что в качестве главною пищевого жира греки и итальянцы используют оливковое масло, а эскимосы - рыбий жир. И оливковое масло, и рыбий жир содержат много ненасыщенных жирных кислот. Если постоянно употреблять их в пищу, то в крови человека резко уменьшается количество холестерина, а следовательно, ослабевает опасность атеросклероза. Каким образом ненасыщенные жиры связывают холестерин в крови, пока еще не установлено.
Высокий уровень холестерина в крови (особенно если он держится длительное время) всегда настораживает врача. Очень важно при этом знать и уровень лецитина - фосфолипида, содержащего азот, и соотношение между содержанием обоих этих веществ. Имеются все основания предполагать, что лецитин препятствует проникновению холестерина в стенки артерий и, следовательно, его отложению в них. Вот почему людям, у которых появились симптомы атеросклероза, рекомендуется есть гречневую кашу, творог и другие продукты, богатые лецитином.
Но не только при атеросклерозе важно знать содержание холестерина в крови. Имеется длинный список болезней, сопровождающихся повышением или понижением уровня холестерина. Кроме того, около трети холестерина находится в крови в свободном состоянии, другая часть его связана с жирными кислотами (эфиры холестерина) .
Врачи всегда интересуются соотношением между свободным и связанным холестерином. Так, например, уменьшение доли связанного холестерина при некоторых болезнях печени (гепатите) заставляют врача призадуматься над судьбой больного. Другие представители липидов крови тоже могут многое рассказать врачу-клиницисту о той или иной болезни. Необходимо только помнить, что для крови очень характерно непостоянство некоторых липидов, особенно жиров: во-первых, отдельные липиды неравномерно распределены между эритроцитами и плазмой (определяют же их обычно в плазме крови); во-вторых, после приема жирной пищи кровь буквально наводняется жирами; и, наконец, что особенно досадно, нет самого главного - единого взгляда ученых на то, что можно считать нормой содержания липидов, особенно жиров. Есть серьезные исследователи, утверждающие, что 100 мл крови здорового человека могут содержать только 10 мг% жира, тогда как другие, не менее солидные ученые считают, что нормальная кровь может содержать и более 200 мг% жира, т. е. в 20 раз больше.
Несмотря на это, можно с уверенностью сказать, что у хронических алкоголиков, при сахарной болезни и некоторых болезнях печени и почек, при беременности (не являющейся, конечно, болезнью), при отравлениях фосфором и другими ядами содержание жиров в крови, как правило, повышено, а при длительном голодании и аддисоновой (бронзовой) болезни - понижено. Другими словами, химический анализ крови на содержание в ней липидов может давать ценные указания врачу.
Кровь содержит большое количество веществ, образующихся при обмене углеводов в тканях организма. Это главным образом органические кислоты: молочная, пировиноградная, лимонная, янтарная. Многие из них представляют значительный интерес для врача, отражая, как в зеркале, состояние организма.
В крови здорового человека содержится 10-20 мг% молочной кислоты. Однако достаточно ему заняться пилкой дров или пробежать на коньках, другими словами, интенсивно поработать, и цифра эта может подскочить до 100 мг%. Таким образом, уровень молочной кислоты - хороший показатель некоторых состояний человека, особенно когда организм ощущает острую нехватку кислорода. Если эта нехватка становится хронической (при некоторых болезнях сердца), содержание молочной кислоты оказывается постоянно повышенным, хотя и не в такой степени, как было указано выше.
По поведению молочной кислоты в крови можно в известной степени судить о тяжести заболевания сердца. В легких случаях уровень ее остается в пределах нормы, но после физической работы поднимается выше, чем у здоровых. При более тяжелых заболеваниях содержание молочной кислоты уже в покое превышает норму, и достаточно небольшого напряжения мышц, чтобы количество молочной кислоты подскочило до высоких цифр. Наконец, у тяжелых сердечных больных молочной кислоты в крови становится больше, чем у здоровых, и при самых ничтожных движениях больного кровь буквально наводняется этой кислотой. Повышенное содержание молочной кислоты в крови наблюдается при раке и других болезнях. У беременных количество молочной кислоты обычно также увеличивается.
Поскольку восстановление гликогена из молочной кислоты осуществляется преимущественно в печени, увеличение содержания молочной кислоты в крови (лактацидемия) указывает в первую очередь на недостаточную функцию названного органа. При тяжелых формах диффузного поражения печеночной ткани, например при циррозах и отравлениях, наблюдается иногда весьма значительное увеличение концентрации молочной кислоты в крови, доходящее до 45 мг%.
С молочной кислотой в крови связана пировиноградная кислота. Количество ее в крови неотступно изменяется в зависимости от колебаний в содержании молочной кислоты. Врачи считают пировиноградную кислоту показателем недостаточности витамина В1. Этот витамин - "специалист" по расщеплению пировиноградной кислоты, и, когда его недостаточно, кислота накапливается в крови.
Диагностическое значение имеет еще одна группа безазотистых веществ - кетоновые тела. К этой группе относится, например, всем нам известный ацетон. В крови здорового человека содержание кетоновых тел (кетонемия) бывает не выше 4 мг%. Но в случаях запущенной сахарной болезни эта цифра может увеличиться в несколько десятков раз. При этом кетоновые тела не только появляются в моче (кетонурия), но содержатся даже в выдыхаемом больным воздухе. Поэтому характерный запах ацетона при дыхании больного нередко может помочь врачу определить сахарную болезнь.
Содержание витаминов в крови здорового человека зависит в первую очередь от характера его питания, так как витамины мы получаем преимущественно с пищей. Но содержание различных витаминов может заметно изменяться при различных заболеваниях. На первом плане стоят желудочно-кишечные болезни, при которых нарушается всасывание витаминов в кишечнике, а также отравления, лихорадочные состояния, малокровие, болезни печени, почек и других органов. Поэтому данные о содержании отдельных витаминов могут помочь врачу при оценке состояния больного. Этому помогает и то обстоятельство, что состав витаминов в крови здорового человека изучен хорошо, хотя содержание некоторых из них не отличается постоянством.
Из жирорастворимых витаминов в крови чаще всего определяют содержание витамина А и его провитамина - каротина. Превращение каротина в витамин А происходит в печени, поэтому болезни этого органа ведут к накоплению каротина в крови до уровня, значительно превышающего нормальное количество (норма 50-280 мкг*). Содержание витамина А повышается при болезнях почек и сахарной болезни.
*(мкг - микрограмм, тысячная доля мг.)
Врачи чаще всего обращают внимание на витамины группы В, особенно витамины B1, РР, В12. Болезни нервной системы, печени, ожирение и другие заболевания часто сопровождаются снижением витамина B1 в крови. При злокачественной анемии в крови снижается содержание и никотиновой кислоты (сосредоточенной в основном в эритроцитах) и особенно витамина В12, который фактически исчезает из крови.
Наконец широко распространено определение в крови и самого популярного витамина - витамина С. Колебания в количестве витамина С отражают качество питания организма и ряд болезненных отклонений в нем. Другие витамины определяются в крови реже. Большой вклад в развитие учения о витаминах внесли советские ученые Н. И. Лунин, Н. Д. Зелинский, А. В. Палладии, В. Н. Букин, Б. А. Кудряшов и др.
Читателю уже известно, что ферменты - биологические катализаторы, обладающие способностью ускорять или замедлять течение различных химических реакций обмена веществ в организме*.
*(Все ферменты - специфические белки. Мы выделяем их в особую группу только потому, что обычно о содержании ферментов в крови судят не по их количеству, а по активности.)
На вооружении каждой клетки нашего тела (и любого живого существа) находится целый арсенал самых разнообразных ферментов, осуществляющих химические процессы обмена веществ в удивительной согласованности друг с другом. Болезнь, нарушающая нормальное течение этих процессов, ломает согласованность, изменяет деятельность ферментов. Естественно, что врачи давно уже проявляют интерес к изучению ферментов как показателей состояния организма.
Кровь сравнительно более доступна для химического анализа, чем другие ткани. Поэтому об изменении в работе ферментов судят в первую очередь по активности их в крови. В настоящее время ученые могут определять присутствие в плазме крови более 50 различных ферментов. Как ферменты попадают в плазму?
Клетки крови - эритроциты, лейкоциты, как и все другие клетки организма, имеют свой набор ферментов. Некоторые ферменты, содержащиеся в плазме, играют определенную роль. Сюда относятся в первую очередь системы ферментов, принимающие участие в свертывании крови. Процесс этот не выяснен полностью, но установлено, что в нем принимают участие несколько ферментов. Присутствие в плазме других ферментов связано с тем, что кровь переносит питательные вещества, поступающие из кишечника. Естественно, что в нее могут попасть и пищеварительные ферменты, выделяемые специальными железами в желудочно-кишечном канале. Понятно также, что при некоторых болезненных состояниях может иметь место перепроизводство ферментов или выход их из поврежденных клеток. Происхождение других ферментов, обнаруживаемых в плазме крови, пока еще не выяснено. Однако в отношении большей части ферментов плазмы установлено, что колебания в их активности могут отражать соответствующие изменения в больных органах, и этим обстоятельством современная медицина пользуется с каждым годом все шире.
Активность многих ферментов при заболеваниях повышается или снижается чрезвычайно резко. Так, например, вместо нескольких единиц кислой фосфатазы в плазме крови больного раком предстательной железы находят около 50 единиц этого фермента! А у ребенка, больного рахитом, можно найти до 200 условных единиц щелочной фосфатазы, тогда как в плазме крови здорового ребенка ее содержится не более 10 единиц. Активность других ферментов меняется в больном организме не так резко, но все же в достаточной степени, что помогает врачу разобраться в ходе заболевания. Так, некоторые болезни сопровождаются распадом эритроцитов, и тогда содержащиеся в них ферменты переходят в жидкую часть крови - плазму. Поэтому при лихорадочных состояниях, некоторых формах малокровия (гемолитическая анемия), шоке и других заболеваниях врач может обнаружить в плазме крови повышенное содержание некоторых ферментов, например "внутриэритроцитного" фермента каталазы, разлагающей ядовитую для организма перекись водорода, или пептидазы - фермента, расщепляющего пептиды (соединения нескольких молекул аминокислоты). При болезнях поджелудочной железы, а иногда и печени в плазме повышается активность амилазы - фермента, расщепляющего полисахариды - крахмал и др. Если нарушается целостность клеток (а это происходит при инфаркте миокарда, повреждениях мышц, некоторых видах рака и других болезнях), то работающий внутри клеток фермент лактатодегидраза попадает в плазму крови.
А вот фермент трансаминаза повышает свою активность в плазме не только при инфаркте миокарда, но и при болезнях печени. Это дает врачу возможность установить, какой из органов поражен в данном случае - сердце или печень. Есть ферменты, активность которых в плазме крови больного понижается при определенных заболеваниях (например, липаза при туберкулезе). Мы не будем перечислять остальные ферменты крови, определение которых помогает врачу установить природу болезни и способы борьбы с ней. Но один из них заслуживает особого внимания.
Нередко при определении общего физиологического состояния организма человека или животного учитывают холинэстеразную активность крови. Почему же фермент холинэстераза вызывает такой интерес?
В деятельности нервной системы организма человека и высших животных большую роль играет ацетилхолин - вещество, передающее нервное возбуждение. Передача нервами возбуждения связана с быстротой расщепления ацетилхолина, а также с быстротой его синтеза и освобождения из связанного состояния, в котором находится часть ацетилхолина, содержащегося в нервной ткани.
В настоящее время различают два фермента, участвующих в превращениях ацетилхолина: ацетилхолинэстеразу, которая содержится в нервной ткани и в эритроцитах, и холинэстеразу, находящуюся в плазме крови и в печени. По активности этого фермента можно судить о деятельности печени, а это очень важно для суждения о состоянии всего организма.
Наряду с ферментами в крови могут содержаться и так называемые антиферменты*. Назначение этих специфических веществ - защищать организм от разрушительного действия определенных ферментов или регулировать их действие. Сыворотка нашей крови, например, содержит антитрипсин. Вспомним, что трипсин - фермент, способствующий перевариванию белков, содержится в соке поджелудочной железы. Долгое время было загадкой - почему эта железа, клетки которой в основном состоят из белков, не подвергается самоперевариванию. Оказалось, что в ней вырабатывается антитрипсин, который связывает трипсин и лишает его активности, тем самым предохраняя железу от переваривания. В кровь антитрипсин попадает, вероятнее всего, из органов пищеварения, откуда ток крови просто захватывает и увлекает с собой некоторую часть антифермента. Это своего рода утечка части продукции из такой фабрики ферментов и антиферментов, какой является поджелудочная железа.
*(П. С. Тонгур. Биологически активные вещества. M., "Знание", 1960.)
Таким образом, антиферменты - факторы естественной защиты организма. Для характеристики их роли приведем еще один пример. Известен фермент гиалуронидаза, свойственный многим бактериям. Он разрушает гиалуроновую кислоту - основное вещество, из которого построено межклеточное вещество многих тканей. Межклеточное же вещество является своеобразным барьером, преграждающим доступ в ткани не только вредных веществ, но и ряда питательных веществ и продуктов обмена. Проницаемость этого барьера может значительно меняться, что в основном зависит от состояния гиалуроновой кислоты. Гиалуронидаза разрушает гиалуроновую кислоту и этим способствует проникновению инфекции и ядовитых веществ из местного очага в глубь тканей организма. Антигиалуронндаза парализует бактериальную гиалуропидазу, что способствует защите организма от определенных микробов.
Некоторые ученые считают, что плазма крови Содержит специальный фермент, разрушающий гиалуронидазу и таким образом защищающий организм от вторжения микробов. Такому ферменту даже дано название антиинвазина (от греческого "анти" - против и латинского "инвазио" - вторжение, нападение). Еслиантиинвазинсуществует, то он представляет собой специальный фактор естественной защиты организма. Его надо отличать от антигиалуропидазы - антифермента, относящегося к антителам плазмы крови, о которых уже упоминалось выше.
Итак, некоторые ферменты крови выполняют в плазме определенные функции, другие оказываются в ней, попав с током крови, оттекающей от различных органов. Немалую роль в переходе ферментов в плазму крови играет также величина молекулы фермента-белка. Частицы таких ферментов плазмы, как альфа-амилаза, рибоиуклеаза, пеисиноген, отличаются сравнительно небольшими размерами, низким молекулярным весом. Ферменты с более крупной молекулой в плазме встречаются гораздо реже. Но наряду с этим в плазме крови отсутствует угольная ангидраза, хотя молекулярный вес ее относительно невелик. В нормальных условиях этот фермент содержится только в эритроцитах крови, и переход его в плазму указывает на заболевание организма гемолитической анемией.
С другой стороны, в плазме встречаются ферменты (например, фосфатаза) с высоким молекулярным весом. Поэтому видеть причины появления в плазме несвойственных ей ферментов только в размерах их молекул было бы неправильно. Более закономерно появление в плазме крови ферментов, которые выделяются вместе с различными соками, например пищеварительными. Такие ферменты легко могут попасть в плазму крови. Попадают в кровь и те ферменты, которые не связаны со структурными образованиями внутри клетки и находятся в клеточном соке. Впрочем, в плазму могут проникать и ферменты, связанные с мельчайшими плотными частичками клетки - микросомами. Если сравнить клетку с заводом или фабрикой (а для такого сравнения есть много оснований), то микросомы - это специализированные Цехи по синтезу белка.
В патологических условиях возникают и другие причины появления ферментов или увеличения их содержания в плазме крови. При нарушении в клетке нормального хода химических превращений в ней производится избыток ферментов, переходящих в плазму крови. Наконец, в больном организме может измениться проницаемость клеточных оболочек, что увеличит "утечку" ферментов.
Нормальная работа желез внутренней секреции может нарушаться - усиливаться или ослабляться - при различных состояниях организма: инфекционных болезнях, отравлениях, повреждениях самих желез, заболеваниях нервной системы и т. д. В результате возникают эндокринные расстройства, нарушающие, гармонию жизни организма как единого целого.
Определение гормонов в крови в ряде случаев помогает следить за деятельностью желез внутренней секреции. В крови человека выявлено более 20 гормонов, которые вырабатываются восемью железами, но не все из них надежно определяются химическими методами. Гормоны щитовидной железы - тироксин, трийодтирозин, связанный с белками,- принято определять по входящему в их состав йоду. Плазма здоровых людей содержит от 2,5 до 5,5 мкг% йода. При одних болезнях (повышенная деятельность щитовидной железы) эта цифра увеличивается, а при других (микседема) понижается.
За последнее десятилетие научная медицина уделяет много внимания надпочечникам. Они выделяют в кровь более 10 различных гормонов - адреналин, норадреналин, кортикостероидные гормоны и т. д. Эти вещества, определяемые химическими методами, хотя и содержатся в крови в минимальных количествах, исчисляемых тысячными долями миллиграмма, могут многое рассказать врачу. Дело в том, что концентрация их в крови может резко возрастать или резко падать при различных заболеваниях.
В клинике широко применяют определение в крови кортикостероидных гормонов. Их содержание составляет в норме не более 30 мкг% и обычно заметно снижается к вечеру. Но при некоторых болезнях (например, при недостаточности надпочечников) содержание кортикостероидных гормонов падает очень резко - до нескольких микрограммпроцентов. При других заболеваниях оно резко повышается.
Способность образовывать специфические химические вещества, действующие "на расстоянии", присуща не только железам внутренней секреции. Все органы и ткани выделяют в окружающую их среду вещества, способные влиять на обмен веществ. Но это, так сказать, "гормоны районного масштаба". Их так и называют: "тканевые гормоны". О них мы расскажем ниже.
Кровь содержит полипептиды, которые можно назвать местными гормонами, так как они оказывают в основном местное действие. Они обладают способностью суживать или расширять сосуды. Так, например, под влиянием фермента почек ренина из содержащегося в крови неактивного ангиотензиногена образуется ангиотензин, который повышает кровяное давление и, кроме того, способствует секреции упомянутого выше гормона - альдостерона.
Есть в крови и другие полипептиды, снижающие кровяное давление. Их называют кининами. Эти вещества - брадикинин, каллидин - связаны в плазме крови белком кининогеном и поэтому не активны. Но как только их отделяют специальные ферменты калликреины, они становятся активными и играют важную роль в регуляции кровяного давления и скорости кровотока.
Сколько же воды содержит кровь - своеобразная жидкая ткань организма? Если сравнить содержание воды в крови и сердечной мышце, то окажется, что оно в обоих случаях почти одинаково. Почему же тогда кровь - жидкость, а сердце - твердое тело?
Жидкое состояние крови определяется ее строением, и белки плазмы играют важную роль, мешая клеткам крови склеиваться и оседать. Содержание воды в крови здорового человека может изменяться, уменьшаясь, например, при обильном потении. Сильно падает оно и при различных болезнях (например, при длительной рвоте, ожогах, так как кровь выделяет при этом не чистую воду, а растворы солей, а иногда и белков). Изменение содержания воды устанавливают путем определения сухого остатка в общей крови и в плазме, а также определения общего количества крови.
В незапамятные времена живые вещества - далекие предки наземных животных и человека - жили в море. И в настоящее время минеральный состав нашей крови напоминает состав морской воды. Однако состав крови неизмеримо сложнее. Кровь содержит более 30 различных минеральных веществ в виде солей и соединений с органическими веществами. Минеральные вещества сконцентрированы в эритроцитах и в жидкой части крови. Нормальный минеральный состав крови человека и возможные отклонения хорошо изучены. Установлено, что он зависит от возраста, времени дня и многих других условий. Соотношения между отдельными минеральными веществами в крови имеют жизненно важное значения для организма.
На минеральный состав крови могут влиять многие болезни. При длительных поносах и рвотах организм теряет большие количества растворенного в воде хлористого натрия, и в крови падает содержание хлора (гипохлоремия). Уровень кальция в крови резко снижается при рахите, тетании, болезнях почек. Содержание меди падает при малокровии. Здесь можно было бы перечислить, конечно, и многие другие болезни. Поэтому определение минеральных веществ в крови с каждым годом получает все большее распространение в клинической практике. Содержание минеральных веществ в крови может в определенных пределах меняться и у здорового человека. Оно зависит от возраста, сезона и многих других причин.
Некоторые минеральные вещества крови играют большую роль в регуляции важных физиологических процессов, так как принимают участие в электрических процессах. Эти вещества называют электролитами, к ним в первую очередь относятся натрий и калий.
Натрий содержится преимущественно в жидкостях организма, а калий - в клетках, следовательно, в эритроцитах крови. Этот элемент играет роль регулятора многих протекающих в организме процессов. Особенно велико значение калия при мышечном сокращении и в проведении нервного возбуждения. Натрий и калий поступают в организм с пищей и из кишечника всасываются в кровь. Соли натрия входят в так называемые буферные системы плазмы крови, роль которых сводится к противодействию резким изменениям реакции крови при поступлении в нее кислот или щелочей.
По данным некоторых ученых, повышение содержания калия отмечается при различных тяжелых состояниях организма независимо от характера заболевания (при повышении тонуса парасимпатической нервной системы, бронхиальной астме, голодании и т. д.). Процессы всасывания калия из желудочно-кишечного тракта и распределения его между жидкостями организма и клетками находятся под влиянием гормонов коркового вещества надпочечников - дезоксикортикостерона и, возможно, других.
Натрий в крови связан преимущественно с хлором и углекислотой, небольшая часть его - с фосфатами и органическими кислотами. Патологические состояния могут изменять эти отношения: при сильных поносах организм выделяет много хлористого натрия, при голодании и значительном потовыделении уменьшается количество натрия в моче, а следовательно, и в крови. Перегревание организма нередко сопровождается тепловыми судорогами. Они являются зачастую следствием обильного питья и чрезмерного потоотделения, в результате чего в крови тоже сильно уменьшается количество натрия и хлора. На содержание натрия в плазме крови оказывают большое влияние гормоны коры надпочечников.
Очень важен для человека хлористый натрий (обычная поваренная соль - хлористый натрий с некоторыми примесями). Недостаток этой соли приводит к ряду нарушений в организме: обезвоживаются ткани, расстраивается кровообращение, теряется аппетит, понижается умственная деятельность. Эти нарушения в большинстве случаев наступают не оттого, что в пище не хватает поваренной соли, а из-за больших потерь соли при некоторых болезнях. Вследствие значительных потерь соли вода хуже задерживается в организме, человек испытывает жажду, много пьет и, страдая от недостатка соли, обычно этого не ощущает, не стремится его восполнить.
Хлористый натрий участвует в регулировании содержания жидкости в крови, влияя на мочеотделение и образование пота. Соль необходима для того, чтобы железы желудка вырабатывали в достаточном количестве соляную кислоту. Соль влияет также на деятельность нервной системы, почек, кровообращение. В организме взрослого человека содержится около 300 г соли; за год человек съедает ее примерно 5,5 кг. Чрезмерное потребление соли вредно для здоровья: при этом нарушается деятельность сердца и почек. В связи с задержкой жидкости в организме могут отекать ноги, развивается общая слабость, изменяется состав крови и тканей, иногда начинается понос в связи с расстройством деятельности кишечника. Людям, страдающим гипертонической болезнью, недостаточной сердечной деятельностью, болезнью почек, необходимо не более 7-8 г поваренной соли в день.
Жидкости организма гораздо богаче хлором, чем плотные ткани. Сыворотка содержит в среднем 370 мг% хлора, водянистая влага глаза - 400, спинномозговая жидкость - 440, лимфа - 420, кожа, легкие, хрящ - 250- 260, мозг - 130, мышца (поперечно-полосатая) и кишечник - 60 мг%. Гладкая мускулатура в два раза богаче хлором, чем поперечно-полосатая.
90% хлора удаляется в основном через мочу, и только 10% выбрасывается с калом и потом. В течение дня с желудочным соком выделяется в два раза больше хлора, чем общее количество этого элемента в крови. В дальнейшем весь этот хлор вновь всасывается. При рвоте же потеря хлора может превосходить общее его количество, циркулирующее в крови, в четыре раза. В патологических случаях количество хлора, связанного с белками эритроцитов, может сильно возрасти.
Гормоны коркового вещества надпочечников влияют на обмен хлора так же, как и на обмен натрия. Недостаточность коркового вещества надпочечников приводит к увеличению выделения натрия и хлора с мочой и соответствующему уменьшению содержания его в крови. Введение экстракта коры надпочечников - кортина - приводит к противоположным результатам - задержке натрия и хлора в организме. Нередко за нарушением хлорного обмена следует нарушение водного. При этом могут наблюдаться два противоположных случая: потеря воды и, наоборот, ненормально большое ее удержание в организме, хотя это на первый взгляд и кажется парадоксальным.
Первый случай, т. е. потеря воды при недостатке хлора - гипохлоремии, встречается иногда у грудных детей - это так называемые дегидратированные дети, теряющие в весе. Причины подобного состояния бывают различные: понос, рвота. Оно наблюдается также при непроходимости кишок (независимо от механизма непроходимости), когда организм вместе с рвотой выделяет большое количество хлоридов и теряет одновременно воду. Гипохлоремия, связанная с тенденцией к удержанию воды в организме, наблюдается при болезнях почек - нефрозах, сопровождающихся повышенным образованием кислот. Гипохлоремия, связанная с повышенным содержанием в крови азотистых веществ, наблюдается иногда при различных болезнях почек. Особую категорию составляют заболевания, возникающие в результате поражения коры надпочечников. В этом случае уменьшается образование гормона, ведающего водно-солевым обменом, вследствие чего почка пропускает слишком большие количества солей и не всасывает их обратно.
Зная содержание хлора в крови и в плазме, можно вычислить содержание этого элемента в эритроцитах. При помощи специального центрифужного прибора (гематокрита) определяют соотношение в крови эритроцитов и плазмы. В норме этот индекс обычно составляет от 0,48 до 0,53. При ацидозе же он повышается до 0,65 и более. Хлор эритроцитов может увеличиться до 235 мг% и больше, а в плазме - снизиться до 210 мг%.
Сера содержится в крови в виде органических соединений и в минеральной форме. Болезни почек, непроходимость кишечника и другие заболевания сопровождаются повышением окисленной серы в крови.
Содержание фосфатов в крови тесно связано с деятельностью желез внутренней секреции: при диабете характерно увеличение содержания фосфатов в крови и сахара. В случае повышенного выделения гормона поджелудочной железы - инсулина (или передозировки его при лечении инсулином) - количество фосфатов в крови уменьшается. В крови фосфат находится в различных соединениях. Часть этих соединений представляет собой неорганические соли фосфорных кислот - ортофосфорной и пирофосфорной с катионами Na, К и т. д. Другая часть фосфора соединена с органическими веществами: это фосфорсодержащие белки, нуклеиновые кислоты, креатин-фосфат, глюкозофосфат и фосфорсодержащие липоиды. Для медиков важно знать величину неорганического фосфора. Однако в последнее время врачи стали интересоваться и липоидным фосфором - лецитином - и лабильными (подвижными, неустойчивыми) фосфатами, количество которых меняется при гипертонической болезни, нарушении кровообращения, окислительных процессах и других заболеваниях. В патологических случаях удается обнаружить в крови креатинфосфат.
В усвоении кальция большую роль играет состояние пищеварительного аппарата. При расстройствах пищеварейия у больных туберкулёзом выделение кальция кишечником увеличивается, и для компенсации приходится увеличивать пищевую дозу кальция. В норме кровь содержит 9-11 мг% кальция. Эта цифра возрастает при повышенной деятельности паращитовидных желез, базедовой болезни, переломах костей. Количество кальция снижается при голодании, бронхиальной астме, рахите, тяжелых болезнях печени и др. Усвоение кальция организмом тесно связано с витамином Д.
Усвоение магния определяется факторами, сходными с теми, которые управляют усвоением кальция, но витамин Д играет здесь, по-видимому, значительно менее важную роль. Повышенное поглощение магния снижает усвоение кальция. Недостаточное поступление магния в организм приводит к тяжелым последствиям. При тяжелых эпилептических судорогах наблюдалось падение магния в крови.
Небольшое увеличение содержания магния в крови происходит при хронических болезнях почек - гломерулонефритах, иногда при детских судорогах, тетании, повышенной функции паращитовидных желез и рахите.
Железо поступает в организм из пищи. Обычный пищевой рацион содержит достаточное количество железа для нормального организма. В патологических случаях его может не хватать. Поглощаемое железо, поступая в кровь и ткани, быстро окисляется и вступает в соединение с глобулином-апоферритином, образуя ферритин, который затем участвует в создании гемоглобина крови. Большая часть железа, имеющегося в организме, входит в состав гемоглобина. Но при различных заболеваниях, связанных с нарушением образования этого пигмента, количество железа в сыворотке увеличивается. Наоборот, при усиленном образовании гемоглобина содержание железа в сыворотке уменьшается. Вообще же из всего железа, содержащегося в организме нормального человека, можно было бы выковать гвоздь средней величины весом в 5 г.
Марганец способствует повышению гемоглобина в крови и снижению уровня сахара в ней. Медь входит в состав некоторых окислительных ферментов крови, усиливает действие инсулина, регулирующего количество сахара в крови. Цинк тоже является составной частью окислительного фермента - угольной ангидразы эритроцитов и усиливает действие инсулина. В составе витамина В12, который обеспечивает нормальное кроветворение, содержится кобальт.
Йод крови делится на две фракции: неорганическая - ее около 30%, и органическая, которая составляет 70% всего йода крови. Органически связанный йод принадлежит тироксину и тироксиноподобным веществам. Остальной органически связанный йод - это главным образом дийодтирозин. В связи с незначительными размерами щитовидной железы концентрация йода в ней приблизительно в 1000 раз больше, чем в других тканях.
Концентрация йода в крови может служить очень чувствительным способом контроля активности щитовидной железы. При повышенной деятельности щитовидной железы, например при базедовой болезни, отмечается увеличение в крови йода, в особенности его фракции, связанной с белками. Лечение йодом в этом случае приводит к уменьшению в крови фракции йода, связанного с белками, тогда как фракция свободного (неорганического) йода увеличивается.
Увеличение йода в крови отмечается также при желчнокаменной болезни, лейкемии (белокровии) и при других заболеваниях, но это увеличение количества йода не носит постоянного характера. Повышение содержания йода в крови происходит при желтухе, злокачественной анемии и некоторых видах злокачественных опухолей. Снижение йода в крови наблюдается при микседеме. Наблюдение за йодом крови в этом случае позволяет установить угрозу кретинизма очень рано, когда другие методы исследования еще бессильны.
В качестве диагностического метода в медицине применяется также определение резервной щелочности, т. е. количества углекислоты, содержащегося в плазме крови в виде бикарбоната. Этот метод полезен для быстрой ориентировки в состоянии буферных систем плазмы крови. Ясно, что чем больше количество двууглекислого натрия в плазме, чем больше ее щелочной резерв, тем выше ее буферная способность по отношению к кислотам. Наоборот, уменьшение количества двууглекислого натрия в плазме показывает, что часть его уже израсходована на нейтрализацию избытка кислот и, следовательно, буферная сила плазмы по отношению к вновь поступающим кислотам уменьшена.
В норме резервная щелочность, выраженная в объемных процентах, колеблется от 45 до 70. Цифры 30-40 объемных процентов обозначают умеренное снижение резервной щелочности, а ниже 30 - резкое падение, указывающее на то, что очень значительная часть резервов щелочи уже израсходована и буферная сила плазмы очень ослаблена. Наоборот, повышение резервной щелочности выше 70 объемных процентов свидетельствует о том, что в плазме крови имеется большое количество двууглекислого натрия и что в организме происходит процесс, ведущий к накоплению щелочей в крови. Определение резервной щелочности дает возможность быстро ориентироваться в том, имеется ли в крови в данный момент избыток кислот или щелочей. Необходимо, однако, подчеркнуть, что определение одной лишь резервной щелочности не может дать никаких указаний относительно характера процесса, ведущего к понижению или повышению содержания двууглекислого натрия в плазме крови.
В 1 мм3 крови в норме содержится 4-5 миллионов эритроцитов. Если учесть, что у человека в организме циркулирует 5-6 л крови, нетрудно подсчитать общее число эритроцитов. Число это колоссально - 25 000 миллиардов. Такое количество эритроцитов вырабатывается в организме в течение 100 дней. Ежедневно с "конвейера" костного мозга - главного органа кроветворения сходит около 300 миллиардов эритроцитов. Бесперебойная работа костного мозга продолжается в течение всей жизни человека. Пользуясь грубым сравнением, можем сказать, что эритроциты - это своеобразное сочетание грузовой баржи с химической лабораторией или фабрикой, в которой осуществляются тысячи разнообразных химических превращений. Эта плавучая фабрика перевозит различные грузы, доставляя их ко всем тканям и органам. В обратный рейс она осуществляет перевозки других продуктов обмена веществ. Естественно, что химический состав эритроцитов и других клеток крови - лейкоцитов, тромбоцитов - заметно отличается от состава плазмы и сыворотки.
Важнейшая функция эритроцитов - перенос кислорода от легких к тканям и углекислоты в обратном направлении. Первая осуществляется содержащимся в эритроцитах гемоглобином, который образует, как мы уже рассказывали выше, оксигемогдобин - химически непрочное соединение с кислородом, обеспечивающее транспорт и передачу этого газа тканям. Только незначительная часть кислорода находится в крови в физически растворенном виде. Углекислота же в основном в виде бикарбонатов переносится как эритроцитами, так и плазмой. Углекислый газ, проникая в ткани и растворяясь в плазме крови, медленно соединяется с водой, образуя угольную кислоту. Этот процесс сильно ускоряется специальным ферментом - угольной ангидразой, которая содержится в эритроцитах, а в плазме отсутствует.
Многие клеточные ферменты, содержащиеся в эритроцитах, переходят в плазму, когда эритроциты разрушаются, например при гемолитической анемии. Только в эритроцитах содержится глютатион - азотистое вещество, играющее важную роль в процессах окисления - восстановления. В химический состав эритроцитов входят и некоторые другие азотистые вещества - аденозинтрифосфорная кислота, эрготионин. В отношении содержания остальных веществ эритроциты отличаются от плазмы только большим (остаточный азот, железо, калий, магний, цинк) или меньшим (глюкоза, витамины, натрий, кальций, алюминий) их количеством.
Другие клеточные элементы крови - лейкоциты, тромбоциты - также отличаются особенностями химического состава, правда, еще не полностью изученными. В частности, лейкоциты содержат гликоген, отсутствующий в эритроцитах. Для врача важно то, что химический состав эритроцитов и лейкоцитов закономерно меняется при некоторых болезнях, а это можно использовать в практических целях для уточнения диагноза болезни.
Итак, кровь содержит огромное количество разнообразных веществ, находящихся в постоянных превращениях. Удобнее всего сравнить ее со своеобразной передвижной химической выставкой молекул. Со всех частей организма сюда собираются разнокалиберные частицы, начиная с исполинских молекул нуклеиновых кислот и белков и кончая крохотными молекулами воды. Но рассказ о крови, ее составе и роли в организме будет неполон, если мы не заглянем туда, где рождается, формируется эта сложная жидкая ткань.
Основная роль в кроветворении принадлежит красному костному мозгу, содержащемуся как в суставных окончаниях трубчатых костей, так и в плоских костях (грудина, лопатки, позвоночник, череп). Здесь образуются в сутки сотни миллиардов эритроцитов. Здесь же формируются лейкоциты и тромбоциты. В процессе кроветворения принимают участие и другие органы тела, в первую очередь селезенка и лимфатические узлы, где образуется особая форма лейкоцитов - лимфоциты. На образование крови в нашем теле влияют многие процессы и, конечно, нервная система, обеспечивающая согласованность между темпами и величиной продукции и деятельностью всего организма.
В регуляции кроветворения значительную роль играют витамины группы В, которых теперь насчитывают 15. В кроветворении принимают участие многие из них, но особенно активен в этом отношении витамин В12. Это вещество обладает способностью ускорять превращение незрелых эритроцитов в зрелые нормальные безъядерные кровяные тельца, которые содержат гемоглобин. Таким образом, витамин В12 может быть назван катализатором кроветворения. Его активность вызывает изумление. Достаточно всего пяти миллионных частей грамма - 5 мкг, чтобы обеспечить ежесуточное производство 300 миллиардов зрелых эритроцитов.
Итак, нормальная жизнедеятельность организма возможна, если костный мозг выпускает совершенно зрелые, безъядерные эритроциты. А для нормального созревания их необходимо, чтобы в организм поступало определенное, хотя и ничтожное, количество витамина В12. И если нормальное снабжение организма этим витамином по той или иной причине нарушается, наступают тяжелые нарушения в составе крови. Может случиться, что в суточном рационе не содержится такое количество витамина В12. Но это возможно только при каких-либо чрезвычайных обстоятельствах. В самом деле, витамин В12 содержится во всех продуктах животного происхождения: мясе, молоке и других продуктах в достаточных для организма количествах. Кроме того, о снабжении организма этим витамином заботятся и бактерии, обитающие в кишечнике и синтезирующие некоторое количество витамина В12. Но при значительных расстройствах кишечник может потерять всасывательную способность, и витамин B12 перестанет поступать в кровь. В результате может возникнуть витаминная недостаточность и как следствие ее острая анемия - малокровие.
Но это только одна из возможных причин возникновения малокровия. Чаще встречается другая причина, когда работа фабрики крови дезорганизуется не по вине плохой работы кишечника, а вследствие расстройства деятельности желудка. Каким же образом желудок может вызвать перебои в работе фабрики крови? Раскрытие этой загадки в последнее десятилетие - большая заслуга ученых. Оказалось, что в слизистой оболочке дна желудка имеются особые клетки, вырабатывающие белковое слизистое вещество, которому дали название гастромукопротеин. Это вещество после всасывания через кишечник в кровь откладывается про запас в печени и затем используется в процессе кроветворения. Считают, что сам по себе гастромукопротеин не влияет на этот процесс, но способствует усвоению витамина В12. Таким образом, если желудок не обеспечит снабжения гастромукопротеином, витамин В12 не включится в процесс кроветворения, и этот процесс дезорганизуется. Таким образом, и в этом случае малокровие вызвано недостаточностью витамина В12. Во многих случаях при остром малокровии достаточно введения в организм препарата В12. Он тотчас же включается в процесс производства нормальных эритроцитов и больной выздоравливает за сравнительно короткий период времени.
Наряду с этим имеются все основания считать, что в крови и желудочном соке содержатся особые вещества - гемопоэтины, способствующие кроветворению, образование и активность которых находится под контролем нервной системы. Никакая фабрика не может работать, если она не обеспечена сырьем для переработки его в готовую продукцию. Один из видов такого сырья для образования красной крови (эритроцитов) - железо, необеспеченность которым также может привести к развитию малокровия. Заболевание в этом случае быстро проходит, если доставить организму достаточное количество железа (особенно в сочетании с витамином С). Нормальный ход кроветворения зависит и от многих других причин, например от гормональных расстройств. Бывают и такие случаи, когда "фабрика крови" производит форменных элементов крови больше, чем нужно. Иногда же организм предъявляет меньший спрос на ее продукцию. Это бывает в горах. В обоих случаях возникает болезненное состояние, наиболее выраженной и довольно тяжелой формой которого является так называемое полнокровие.
Важной частью процесса кроветворения является и разрушение форменных элементов. В этом отношении особенно активна селезенка - орган, который может быть назван кладбищем эритроцитов. Разрушая их, селезенка одновременно помогает организму использовать оставшиеся обломки на воссоздание новых красных кровяных телец.
Интересно отметить, что гемоглобин и продукты его распада определяют окраску тканей нашего тела. Алый цвет артериальной крови связан с присутствием соединения гемоглобина с кислородом - оксигемоглобина, а синеватая окраска венозной обусловлена соединением гемоглобина с углекислотой - карбоксигемоглобином. Желтый цвет жира и ярко-красный мышц, желто-зеленая окраска желчи и янтарная мочи - все это обусловлено продуктами распада или превращения гемоглобина. Процессы кроветворения и кроверазрушения тесно связаны между собой и так же, как и состав крови, регулируются нервной системой. Поэтому следует говорить о единой системе крови в организме.
До сих пор мы говорили об органах кроветворения и их продукции. Но организм как заправский хозяин имеет не только производство, но и складские помещения. Роль таких складов выполняют органы, которые содержат в своих сосудах значительные количества не принимающих участия в кровообращении запасных эритроцитов. В организме животных таким складом является в первую очередь селезенка, а у человека - печень, сплетения венозных сосудов в коже и легкие. Эти органы называют депо крови. В них может откладываться около половины всего количества эритроцитов крови. Когда происходит значительная потеря крови или нарушается кроветворение, в кровяные депо поступает сигнал о необходимости мобилизовать резервы эритроцитов. Депо незамедлительно опорожняются и вливают в общий ток крови запасные количества красных кровяных телец. Сигналы о недостатке эритроцитов могут быть различными, но основной из них - недостаток кислорода, который возникает при обеднении крови гемоглобином.
Кислородное голодание, наступающее и от других причин, тоже является стимулом к опорожнению кровяных депо. Такое состояние можно часто наблюдать на больших высотах в горах. Конечно, в этих условиях мобилизуется костный мозг, образующий повышенное количество красных кровяных телец, миллиарды которых устремляются к легким. Но при резком уменьшении кислорода организм привыкает к внезапному и быстрому опорожнению резервуаров - кровяных депо. В аварийных условиях увеличение числа кровяных телец происходит с такой скоростью, которая не может быть результатом деятельности кроветворных органов.
В 1949 г. выдающийся американский химик Полинг обнаружил в эритроцитах больных особой формой анемии гемоглобин, молекула которого отличалась по элекрофоретической подвижности от нормального гемоглобина. Так была вскрыта еще одна врожденная ошибка обмена веществ - образование "уродливой" молекулы гемоглобина и родился термин "молекулярная болезнь".
Совсем недавно Полинг высказал мнение, что представление о молекулярной болезни в некотором роде искусственно. Мы можем сказать, что любая активность человеческого организма является молекулярной, так как человеческий организм состоит из молекул, а носители болезней - вирусы и фаги - тоже состоят из молекул. Кроме того, образование аномального гемоглобина при серповидно-клеточной анемии является характерным признаком этой болезни и происходит в результате мутации гена у больного. Сам по себе ген - это молекула, а болезнь может называться молекулярной потому, что она возникает в результате измененной, мутировавшей молекулы ДНК-гена. В этом плане все болезни, возникающие в результате генных мутаций и врожденных ошибок обмена, могут рассматриваться как молекулярные.
Все тот же Полинг считает, что болезни, появляющиеся в результате изменений структуры человеческого тела и не сопровождающиеся какими-либо изменениями в природе составляющих их молекул, например помешательство после удаления части мозга, не могут быть названы молекулярными.
Советский ученый В. А. Орехович указывает, что нельзя называть любые изменения в генетическом аппарате клетки молекулярными болезнями. Встречаются такие изменения в превращениях крупных молекул или такие частичные изменения в превращениях тех или иных веществ, которые не вызывают нарушения процессов жизнедеятельности. Болезней молекул нет, а есть болезненные состояния организма, выражающиеся в плохой работе отдельных органов или целого организма. Добавим от себя, что даже в приведенном выше примере Полин-га удаление части мозга обязательно приведет к дефектам в совокупности химических реакций, протекающих в мозге (да и не только в мозге). Следовательно, в известном смысле все болезни человека можно считать молекулярными.
В молекуле гемоглобина здорового человека содержатся следующие четыре пептидные цепи: альфа, которая содержит 141 аминокислоту, бета, гамма и дельта (по 146 аминокислот в каждой). В состав каждой молекулы входят две пары идентичных полипептидных цепей. Но они могут сочетаться различным образом*. Почти 97% всего гемоглобина здорового человека составляет сочетание двух альфа-цепей с двумя бета-цепями (что принято обозначать: HВА - α2β2, где HВА - гемоглобин А, α2 - две альфа-полипептидные цепи, β2А - две бета-полипептидные цепи. Около 3% приходится на долю гемоглобина А, в котором две цепи альфа сочетаются с двумя цепями дельта - (HВА - α2δ2). Но у новорожденного еще сохраняется от зародыша особый вид гемоглобина (о котором будет сказано ниже), состоящий из двух цепей альфа и двух цепей гамма. Таким образом, две цепи альфа содержатся в любой разновидности нормального гемоглобина, а остальные две цепи синтезируются лишь в определенные периоды жизни.
*(Интересно отметить, что по аминокислотному составу различные полипептидные цепи иногда удивительно схожи. Так, например, девять десятых аминокислотных участков в бета- и дельта-цепях ничем не отличаются друг от друга. Гораздо меньше, но все же немало идентичных участков в альфа- и бета- или альфа- и гамма-цепях (40%); значительно больше их в бета- и гамма-цепях (70%). Отсюда можно сделать вывод, что эти цепи произошли одна из другой в процессе эволюции. Наиболее старой, вероятно, является альфа-цепь, ген которой мог подвергнуться дупликации. Появился второй ген альфа-цепи. Но в дальнейшем эволюция обоих генов могла идти независимо друг от друга и привести к двум различным генам: одному - для альфа-цепи и другому - для гамма-цепи. Продолжая рассуждение, легко представить себе возникновение гамма-цепи из бета-цепи и сравнительно недавно дельта-цепи из бета-цепи, на которую она очень похожа.)
Но вернемся к открытой Полингом анемии. Эта форма анемии, так называемая серповидно-клеточная анемия, известна с 1910 г. как тяжелое врожденное заболевание. Заслуга Полинга в том, что он впервые наглядно доказал зависимость этой болезни от образования ненормальных молекул гемоглобина*. Но надо было еще выявить, в чем причина такой ненормальности. Это удалось сделать позднее путем тщательного изучения строения глобина. Уродство молекулы анормального гемоглобина (его называют гемоглобин S от первой буквы английского термина "Sickle celh - серновидная клетка) заключается в замене только одной молекулы, а именно глютаминовой кислоты валином. В данном случае валин - "ложная" аминокислота, пришелец, вторжение которого в молекулу приводит к тяжелому заболеванию. Почему же это происходит?
*(Если взчть кровь человека с таким гемоглобином в пробирку и добавить вещество, уменьшающее содержание кислорода в крови, то эритроциты принимают серповидную форму.)
Дело в том, что ненормальный гемоглобин в восстановленном виде в пятьдесят раз менее растворим, чем нормальный оксигемоглобин. Вследствие этого он легко кристаллизуется внутри эритроцита и тем самым изменяет его форму. Такие эритроциты закупоривают сосуды, что проводит к инфаркту и другим тяжелым осложнениям: тромбозу, массовому гемолизу (растворению) эритроцитов. Особенно тяжело протекает серповидно-клеточная анемия у детей, у которых оба родителя являются носителями аномального гемоглобина.
В настоящее время известно уже много ненормальных гемоглобинов, в которых имеется неправильная последовательность аминокислот или же неправильное присоединение отдельной аминокислоты. Но где источник ошибок? Тут многое может объяснить генетика, хотя некоторые из этих пояснений еще нуждаются в доказательствах. Весьма вероятно, что неправильности в чередовании аминокислот возникают в результате ошибки при копировании целых участков полипептидных цепей.
В вводной части мы упоминали о том, что такое пистрон. Можно предположить, что когда ненормальные гемоглобины различаются единственно местом расположения участка, например дельта- и бета-цепи, то источником ошибки может служить кроссинговер (перекрест) в области цистронов, определяющих последовательность аминокислот цепей бета и дельта. Источники ошибок могут лежать также в различной скорости синтеза отдельных полипептидных цепей.
Для обозначения гемоглобинов принято пользоваться буквами. Но и нормальных гемоглобинов несколько, так как у человека они образуются в различные стадии развития. Еще 100 лет назад было установлено, что кровь плода и кровь пуповины содержат особый гемоглобин, который гораздо легче насыщается кислородом, даже при недостатке последнего, а это помогает плоду приспосабливаться к среде, бедной кислородом. Этот гемоглобин обозначают буквой F (от латинского "фетус" - плод). В крови взрослого человека резко преобладает нормальный гемоглобин А и содержится лишь небольшая примесь других гемоглобинов: разновидностей гемоглобина А и гемоглобина S никак не более 10%. Но после открытия гемоглобина S с его уродливой молекулой за последние годы выявлено столько ненормальных гемоглобинов, что для обозначения их не хватает букв алфавита*. Лучше других изучены гемоглобины A, S, С. Интересно, что ненормальность молекулы у этих гемоглобинов проявляется всегда в одном участке, где происходит замена глютаминовой кислоты другими аминокислотами. Едва ли это случайность. Скорее можно предположить какую-то неустойчивость в том отрезке ДНК, который управляет синтезом этого участка.
*(Совсем недавно Полинг сообщил, что обнаружено 100 аномальных гемоглобинов, причем уродство каждого из них состоит в замене одной аминокислоты другой в альфа- или бета-цепи. В настоящее время принято обозначать вновь выделяемые гемоглобины названиями тех местностей и городов, где они были обнаружены, например гемоглобин Цюрих, гемоглобин Бостон и т. п. Предложены и более точные способы наименований, отмечающие, какая именно аминокислота подверглась замене.)
Белок пормального гемоглобина - глобин - имеет сравнительно небольшую молекулу (молекулярный вес 68000) и состоит из четырех пептидных цепей: по две цепи альфа и бета. В гемоглобине человеческого плода две пары идентичных цепей обозначают как альфа- и гамма-цепи. Каждая цепь содержит приблизительно по 140 аминокислот, расположенных в определенной последовательности. Английский биохимик Ингрэм расщепил молекулу нормального и "больного" гемоглобина не на сотни аминокислот, а всего на 28 пептидов, при помощи электрофореза и хроматографии разделил на бумаге, окрасил специальной краской и получил, таким образом, пептидные карты различных пептидов. Сравнивая эти отпечатки между собой, он нашел, что в одном из пептидов ненормального гемоглобина глютаминовая кислота заменена валином. Этот метод был успешно применен к другим гемоглобинам. Химическое строение всех известных в настоящее время многочисленных видов гемоглобина полностью не выяснено. Но ясно, что различие между ними обусловлено различиями в строении молекулы. И в основном это удалось выяснить благодаря пептидным картам.
Но как именно открывают аномальные гемоглобины? Приведем пример.
У членов одной английской семьи, проживающей в Норфольке, исследовали кровь. При электрофорезе (см. раздел Кровь, настоящего издания) выяснилось, что молекула гемоглобина этой крови обладает большей подвижностью, чем нормальный гемоглобин А. Другой исследователь, заинтересовавшись вновь открытым гемоглобином Норфольк, разъединил как этот гемоглобин, так и нормальный гемоглобин на пептидные цепи и рекомбинировал их. Таким образом удалось показать, что в гемоглобине Норфольк имеются аномальные альфа-цепи.
Другая группа ученых проделала то же самое со смесью аномальных гемоглобинов S и Норфольк (отметим, что в гемоглобине S альфа-пептидные цепи нормальны) и получили нормальный гемоглобин А. Это означало, что в гемоглобине Норфольк бета-цепи нормальны и аномальны только альфа-цепи. С помощью пептидных карт окончательно установили, что в положении 57 вместо остатка глицина в альфа-цепи гемоглобина Норфольк содержится аспарагиновая кислота. Так был найден виновник ненормальности гемоглобина.
Как уже упоминалось, молекула гемоглобина состоит из четырех полипептидных цепей, или субъединиц, не связанных одна с другой. О таких белках говорят, что они обладают четвертичной структурой. Субъединицы гемоглобинов можно отделять друг от друга и воссоединять. Интересно, что молекулы гемоглобинов разного типа могут обмениваться субъединицами, образуя своеобразные гибриды. Уже получены гибриды гемоглобинов собаки и человека, мыши и осла и т. д. Эта способность к гибридизации очень помогает ученым определять идентичность двух сравниваемых гемоглобинов.
Что касается четвертичной структуры гемоглобина, то она играет большую роль в его способности присоединять к себе кислород (он переходит при этом в оксигемоглобин) и отдавать его, другими словами, осуществлять транспорт кислорода в организме.
Врожденные ошибки кроветворения, сопровождающиеся появлением в эритроцитах несвойственных здоровым людям гемоглобинов, принято называть гемоглобинозами, или гемоглобинопатиями. Такие гемоглобинозы могут быть и безвредными и очень тяжелыми для здоровья человека. И здесь решающую роль играют гены. Если ребенок наследует гемоглобин от одного из родителей по гетерозиготному типу, то гемоглобиноз протекает безобидно. Но если гемоглобиноз наследуется по гомозиготному типу, т. е. от обоих родителей, то развивается тяжелейшее заболевание, приводящее к смерти.
Как мы уже упоминали, нормальный гемоглобин А состоит также из отличающихся один от другого гемоглобинов: А1, А2. Количество гемоглобина A2 у здоровых людей не превышает 3,5% от общего гемоглобина. При талассемии уровень этого гемоглобина повышается настолько, что позволяет врачу устанавливать характер заболевания. Это очень важный признак, позволяющий обнаружить легкие его формы, так как других проявлений болезни очень мало. Эту легкую форму заболевания так и называют "талассемия минимальная". Наблюдается она у детей гетерозиготов и лечения не требует*. Несколько выраженнее болезнь при талассемии у взрослых гетерозиготов, носящая название средиземноморской анемии взрослых.
*(Совсем недавно было показано, что дети с талассемией отличаются пониженным содержанием аскорбиновой кислоты в крови. Вероятная причина этого - дефект всасывания витамина С из кишечника.)
Вообще в эритроцитах крови гетерозиготов содержится менее 50% аномального гемоглобина S и более 50% нормального гемоглобина А. Такая кровь у практически здоровых людей, но им нельзя заниматься альпинизмом. И уж, конечно, полеты на самолетах (без кислородного обеспечения) не для них. Все это потому, что недостаток кислорода может вызвать резкое обострение болезни.
Тяжелым заболеванием является средиземноморская анемия детей - талассемия майор. Эта гомозиготная форма уже с первых месяцев жизни проявляется в виде неуклонно увеличивающейся анемии. Характерны резкое увеличение печени и селезенки, бледность и желтушность кожных покровов, истончение и разрушение костей, шум в сердце, монголоидные черты лица, недоразвитость, резкие изменения в картине крови и смертельный исход це позднее чем к 10 годам со дня рождения. Радикальных способов лечения пока не найдено. При средних формах талассемии удаление селезенки иногда дает благоприятный эффект.
Большую роль в характере гемоглобиноза играет полярность - равномерность распределения аминокислотных остатков в полипептидных цепях молекул. Так, например, при гемоглобинозе С почти весь гемоглобин в эритроцитах относится к типу С. И хотя ошибка природы и здесь приводит к замене в бета-цепи одной аминокислоты на другую (в частности, глутаминовой кислоты на лизин), но эта замена происходит без изменения полярности. Несмотря на широкую распространенность этого гемоглобиноза, характерная для него гемолитическая анемия выражена слабо. Ломкость эритроцитов снижена, но и период продолжительности их жизни несколько снижен. Содержание гемоглобина может оставаться в пределах нормы. Проявления болезни неясны и неопределенны. Природу гемоглобиноза С удается установить главным образом по своеобразному поведению молекул этого типа во время электрофореза. Этот гемоглобиноз не ведет к гибели больных. Вспомним, что в гемоглобине S в бета-цепи глутаминовая кислота заменена валином. Но при этом происходит изменение полярности аминокислот, что вызывает грубое нарушение свойств молекулы гемоглобина. А в результате больные гомозиготной формой этого гемоглобиноза погибают еще в раннем детстве.
Сравнительно доброкачественно протекают гемоглобинозы Е, Д, Н.
Гемоглобинозы могут быть и смешанной формы у одного и того же больного. В эритроцитах людей, страдающих талассемией, наряду с гемоглобином А обнаружено повышенное содержание гемоглобина F, который содержится в крови зародыша человека. Сравнительно много в них и гемоглобина А2. Но ведь молекулы всех этих гемоглобинов не изменены. Где же ошибка? Надо полагать не в химическом "уродстве" молекул гемоглобина. И здесь на сцену снова выступает ген.
Оговоримся, что точное место ошибки пока нельзя считать установленным. Но можно предположить, что такая ошибка происходит при образовании информационной РНК. Назначение этой кислоты в данном случае - обеспечить правильную информацию той системы, которая ведает синтезом альфа- или бета-цепи гемоглобина. Но происходит ошибка, возникает неполноценная РНК, которая блокирует, если не все, то немалое количество рибосом, занятых синтезом гемоглобина. В результате эритроциты не получают достаточного количества гемоглобина и становятся ломкими. Поступив в кровяное русло, они разрушаются, а это вызывает тяжелую анемию. Правда, организм вырабатывает повышенные количества гемоглобинов F и А2. Но полностью выправить ошибку ему не удается, потому что синтез гемоглобина блокирован на многих рибосомах.
В чем причина возникновения молекулярных аномалий гемоглобина?
Известно, что такие гемоглобинопатии распространены в малярийном поясе по берегам Средиземного моря (отсюда и название "средиземноморская"), в Африке, Индии. В некоторых странах, например в Гане, таких больных особенно много. Были изучены молекулярные аномалии гемоглобина крови человека*. Гемоглобин - главное питательное вещество для возбудителя малярии. Малярийный паразит может питаться только высококачественным, нормальным гемоглобином. Едва заметное изменение в чередовании аминокислот гемоглобина - и особый фермент малярийного плазмодия прекращает свою деятельность. Создается впечатление, что этот фермент может атаковать молекулу гемоглобина только через участок глютаминовой кислоты.
*(Интересно отметить, что аномальные гемоглобины были впервые открыты у негров. Это обстоятельство тотчас было подхвачено расистами США как доказательство неполноценности африканской расы. Каков же был их конфуз, когда впоследствии такие гемоглобины были обнаружены у испанцев, итальянцев, греков и т. д.)
Хотя анемия передается по наследству, но у детей гетерозиготов почти три четверти всего запаса гемоглобина остается совершенно неизменными - с нормальными молекулами. Изменению подвергается только ничтожная часть - 1/700 - аминокислот гемоглобиновых молекул эритроцита. В физиологических условиях содержание нормального гемоглобина в крови здорового человека колеблется в гораздо более широких пределах, но это не мешает ему служить пищей возбудителю малярии. В чем же тут дело? Можно предположить, что та мутация, которая создает уродливую молекулу гемоглобина, затрагивает аминокислоту, далеко не безразличную для малярийного плазмодия. Замена такой аминокислоты делает всю молекулу недоступной для фермента, защищает гемоглобин, а с ним вместе и жизнь его носителей*. И это защитное приспособление в конечном счете спасло от малярии много миллионов людей, одновременно убивая миллионы детей в каждом поколении.
*(Немалую роль здесь, вероятно, играет то обстоятельство, что глутаминовая кислота сообщает эритроцитам отрицательный заряд (и это "по вкусу" малярийному плазмодию), а заменяющий ее валин нейтрален.)
Несмотря на сложность, молекула гемоглобина легко распадается. При кислой реакции нормальный гомоглобин А распадается на две половинки, которые при подкислении снова соединяются в гемоглобин. Такое воссоздание молекулы гемоглобина носит название рекомбинации. Методы рекомбинации сыграли большую роль в изучении ненормальных гемоглобинов.
Как известно, гемоглобин можно называть восстановленным гемоглобином, так как он не содержит кислорода и, только соединяясь с кислородом, образует оксигемоглобин - очень нестойкое соединение. Но если двухвалентное железо гемоглобина окислить в трехвалентное, о возникает метгемоглобин, который уже не способен больше связывать кислород и поэтому выключается из его транспорта. В организме имеется система ферментов, восстанавливающих постепенно небольшие количества метгемоглобина, что не дает ему накапливаться в количествах, превышающих 2%. Главную роль здесь играет метгемоглобинредуктаза, которая восстанавливает метгемоглобин в гемоглобин и тем самым возвращает его в строй переносчиков кислорода.
Именно в активности метгемоглобинредуктазы сказывается наследственно передаваемая ошибка обмена веществ. Фермент не успевает переводить весь образующийся метгемоглобин в гемоглобин. В результате нарушается равновесие между процессами окисления гемоглобина в метгемоглобин и процессами восстановления гемоглобина. Если дело не заходит слишком далеко и накопление метгемоглобина не велико, организм может справиться с этим. Но когда содержание метгемоглобина превышает определенный уровень (а в некоторых случаях оно может составить более половины всего количества гемоглобина), организм может задохнуться. Доминантно наследуемая метгемоглобинемия характеризуется наличием в крови не только нормального гемоглобина А, но и аномальных молекул гемоглобина М. Возможно, что под влиянием мутантного гена в белковой части этого гемоглобина образуется такая группа атомов, которая соединяется с трехвалентным железом. Наследственная метгемоглобинемия еще в раннем детстве проявляется в синюшности (цианозе), кровь окрашена в бурый цвет, так как содержит повышенные количества метгемоглобина.
Таким образом, существуют две формы наследственной метгемоглобинемии. Одна из них связана с ошибкой, которая сказывается в частичном или полном блокировании ферментной системы, превращающей метгемоглобин в гемоглобин. Другая характеризуется возникновением уродливой молекулы гемоглобина, не поддающейся действию фермента метгемоглобинредуктазы. Наличие такого гемоглобина в эритроцитах и вызывает стойкую синюшность и приступы удушья (наследование по доминантному типу).
В чем причина ненормальной устойчивости метгемоглобина? Вспомним, что в полипептидной цепи нормального гемоглобина гем как бы подвешен между двумя молекулами аминокислоты гистидина. У этой аминокислоты нет свободного бокового химического щупальца. Но если в результате ошибки происходит замена гистидина на другую аминокислоту, настолько агрессивную, что она может соединиться с гемом и заморозить гемоглобин в его связи с железом, то образуется стойкий метгемоглобин.
Метгемоглобинемия может быть и не наследственного характера. Она может развиться при некоторых инфекционных болезнях, а также иногда при эклампсии беременных. Чаще всего не наследственная метгемоглобинемия вызывается отравлением различными веществами (бертолетовой солью, нитритами, анилином и т. д.). Но между метгемоглобинемией, вызванной отравляющими веществами и наследственной метгемоглобинемией, имеется существенное различие. В первом случае в крови больного, рставленной в сосуде на некоторое время, метгемоглобинемия постепенно исчезает. При наследственной болезни этого самопроизвольного восстановления метгемоглобина не происходит. Следовательно, нарушение в случае врожденной метгемоглобинемии не обусловлено ненормальностью процессов окисления, а вызывается нарушением или отсутствием процессов ферментативного восстановления. Это было установлено исследованиями английского биохимика Гибсона, который сначала показал, что в здоровом организме возвращение метгемоглобина в строй переносчиков кислорода тесно связано с тем этапам распада глюкозы, в котором принимают активное участие переносчики водорода НАД и метгемоглобинредуктаза. Гибсон проследил шаг за шагом те же процессы в крови пяти сестер, больных врожденной метгемоглобинемией. Оказалось, что распад глюкозы (гликолиз) и переносчик водорода НАД функционируют нормально, а ошибка метаболизма проявляется в отсутствии или недостаточной активности метгемоглобинредуктазы.
Одновременная болезнь близких родственников (сестер) при полном благополучии родителей указывает, что болезнь носит рецессивно-наследственный характер. Наследственная метгемоглобинемия - редкое заболевание.
В настоящее время известно около 100 случаев. Для лечения метгемоглобинемии применяют метиленовую синь и аскорбиновую кислоту. Метиленовая синь и раньше с успехом применялась при лечении метгемоглобинемии, вызванной отравляющими веществами. Прием метиленовон сини в терапевтических дозах 1-2 мг на 1 кг веса тела ведет за короткое время к полной ликвидации метгемоглобина. Очевидно, благоприятное действие метиленовой сини заключается в том, что она как бы открывает другой путь превращений, привлекая к участию в восстановлении метгемоглобина не НАД, а другой переносчик водорода - НАДФ.
Что касается аскорбиновой кислоты, то ее действие проявляется в непосредственном восстановлении метгемоглобина. Аскорбиновую кислоту необходимо применять в больших дозах. Действие ее сказывается намного позднее, чем метиленовой сини. Она резко уменьшает содержание метгемоглобина, но не устраняет его полностью и только способствует установлению равновесия при концентрации метгемоглобина на уровне 1%.
В незрелых красных кровяных клетках, как известно, первой реакцией синтеза гема является взаимодействие глицина с янтарной кислотой, после чего открывается цикл химических превращений. Уже в начале его образуется дельта-аминолевулиновая кислота, часть которой "выбывает" из этого цикла и идет на построение гема. Для этого две молекулы кислоты соединяются в одно целое, образуя из четырех пиррольных ядер уропорфириноген. Из него образуются другие порфириногены - копропорфириноген и протопорфириноген. Каждый из них, меняя характер мостиков, соединяющих пиррольные ядра, может превратиться в соответствующие порфирины - уропорфирин, копропорфирин и протопорфирин. Из протопорфирина в молодых эритроцитах путем включения железа (при непременном участии витамина В12, меди и тетрагидрофолиевой кислоты) синтезируется гем, который вместе с глобином образует гемоглобин.
Порфирииов существует очень много. Все они имеют одинаковый скелет из четырех пиррольных ядер, но отличаются характером боковых групп. В организме человека встречаются следующие порфирины - копропорфирины I и III, уропорфирины I и III, дейтеропорфирин IX, протопорфирин IX, мезопорфирин IX.
Синтез протопорфирина и образование гема являются ферментативными реакциями. Именно на этих путях совершаются ошибки, лежащие в основе молекулярных болезней порфиринового обмена. В чем проявляются эти болезни?
Врожденная эритропоэтическая (фотосенсибилизирующая) порфирия характеризуется чрезмерным выделением одного или нескольких порфирииов в моче. Это тяжелое заболевание, наследующееся аутосомнорецессивно. Оно проявляется вскоре после рождения и характеризуется выделением красной мочи, содержащей большое количество уропорфирина. Уже в первый год после рождения под влиянием солнечных лучей на открытых участках тела появляются плохо заживающие пузыри и язвы. Селезенка резко увеличивается. Развивается анемия, сопровождающаяся распадом эритроцитов. Болезнь встречается редко. В литературе описано менее 50 случаев в различных странах. Интересно, что эта болезнь встречается и у крупного рогатого скота.
Здоровый человек выделяет с суточной мочой не более 30 мкг уропорфирина и 300 мкг копропорфирина. У детей, больных порфиринурией, выделение уропорфирина с мочой может увеличиться в 1000 раз, а копропорфирина - в 15 раз. Резко повышается и выделение копропорфирина с калом. Параллельно повышается и уровень этих порфиринов в плазме и эритроцитах. В тех случаях, когда эта болезнь сопровождается повышенным распадом эритроцитов, повышается выделение с калом уробилиногена - продукта распада протопорфирина.
Место ошибки обмена веществ в молекулярных основах этой болезни пока еще не определено точно. Вероятен дефект ферментов, участвующих в превращении порфобилиногена в уропорфириноген. Не так давно у таких больных было обнаружено большое количество уропорфириногена III наряду с большим количеством уропорфириногена I. Повинен в этом фермент изомераза, переводящий порфириноген в уропорфириноген III. Фермент явно не справляется с работой, поэтому значительная часть порфириногена переходит в уропорфириноген I. Это можно назвать биохимическим атавизмом (возвратом признаков далеких предков). Другая форма такой порфирии обнаружена в последнее время всего у нескольких человек - членов одной семьи. Наиболее характерным признаком ее является значительное повышение содержания протопорфирина в эритроцитах, в кале. Эта "эритроноетическая протопорфирия" является следствием генетического дефекта. Но место ошибки пока не установлено.
Несколько иная (печеночная) форма нарушения порфиринового обмена носит название шведской перемежающейся острой порфирии. Она наследуется аутосомнодоминантно и проявляется к периоду половой зрелости в виде поражения печени, а также желудочными болями и нервными расстройствами. В моче выделяются большие количества порфобилиногена и дельта-аминоловулиновой кислоты. Приступы болезни чередуются с промежутками, когда нет никаких признаков заболевания. Колики в животе носят настолько тяжелый характер, что напоминают такие болезни, как прободение при язве желудка или воспаление поджелудочной железы. Нервные расстройства выражаются в болях, слабости, затруднениях при глотании, отрыжке. Эта форма порфирии встречается гораздо чаще предыдущей. Около 200 случаев обнаружено только в США, а в Швеции, несмотря на значительно меньшую численность населения, почти столько же, особенно в Лапландии, где на 100 человек населения встречается один больной.
Мы уже упоминали, что для шведской формы порфирии характерно выделение больших количеств порфобилиногена и дельта-аминолевулиновой кислоты с мочой. В суточной моче здорового человека содержится менее 2 мг обоих этих веществ. Больные во время приступа могут выделять в 100 раз большие количества. Менее характерно увеличение выделения порфиринов, которое также наблюдается при этой форме болезни. Где происходит ошибка обмена веществ в данном случае?
Выделение больших количеств дельта-аминолевулиновой кислоты и порфобилиногена указывает, что блокирование обменных превращений должно происходить где-то после образования этих химических предшественников порфиринов. Если дать здоровому человеку проглотить дельта-аминолевулиновую кислоту, выделение этого вещества или порфобилиногена не увеличивается. Очевидно, здоровый организм сохраняет способность превращать эти вещества в порфирины и гемоглобин. Но прием дельтааминолевулиновой кислоты при шведской форме порфирии влечет за собой выделение повышенных количеств порфобилиногена с мочой. Очевидно, выпадает действие ферментов, осуществляющих дальнейшие превращения этих веществ.
Шведская порфирия может, и довольно часто, как бы притаиться и притом на всю жизнь. Такая латентная форма болезни встречается у родственников (особенно у детей и племянников) больных с открытой острой порфирией. Болезнь не проявляется клинически болями, нервными расстройствами или повышенной чувствительностью к свету. Единственный признак - выделение больших количеств дельта-аминолевулиновой кислоты, порфобилиногена и порфиринов, иногда на протяжении многих десятков лет. Встречаются такие скрытые формы порфирии, которые проявляются только после приема различных лекарств, в первую очередь барбитуратов и сульфамидных препаратов.
Наконец, существуют смешанные формы порфирии, при которых под влиянием солнечных лучей на коже появляются пузыри. Возможно, что это происходит вследствие ускоренного окисления светом клеточных белков кожи. Известно также, что свет, особенно его ультрафиолетовая часть, способствует быстрому превращению предшественников, например уропорфириногена, в уропорфирин. Возможно, что это происходит в поверхностных капиллярах кожи. При смешанных формах порфирии такие кожные проявления сочетаются с накоплением копропорфирина и протопорфирина в печени, повышенным выделением их с калом и приступами желудочных болей. Наследственный (аутосомно-доминантный) тип этой болезни хорошо прослежен на шести поколениях (с 1814 г. до наших дней) у буров в Южной Африке.
Большую роль в проявлении болезни играет повышенная чувствительность к свету, особенно к ультрафиолетовым лучам, которые провоцируют болезнь. Дело в том, что в результате накопления порфиринов в коже и жидкостях организма облучение вызывает довольно тяжелые повреждения кожи и подкожной клетчатки. Но ведь чувствительность к свету - это относительный симптом, зависящий от облучения и наличия порфиринов. Если убрать свет, другие признаки порфирина (кроме кожных) сохраняются. Значит, виноваты сами порфирины? Сомневаться тут не приходится. Накопление определенных форм порфиринов ведет к таким последствиям (спазмы кровеносных сосудов и кишечника, тяжелые поражения центральной нервной системы), что ядовитость порфиринов, казалось бы, в доказательствах не нуждается. И все же доказательства нужны потому, что введение порфиринов (или их предшественников) животным таких последствий не вызывает. Впрочем, у мышей введением одного из антибиотиков (или свинца) вызвать порфирию удалось. Но эта порфирия несколько отличается от человеческой. У других видов животных порфирию не удалось получить. Возможно, что у мышей имеется ошибка обмена, мешающая соответствующим ферментам "расправляться" с этим антибиотиком. Весьма вероятно, что болезнь эта ведет начало от одной супружеской пары голландцев, которые поженились в Южной Африке в 1688 г. и дали огромное потомство. Достаточно сказать, что за последние 150 лет один из потомков к настоящему времени стал предков 500 человек. Этой форме порфирии также дают название "поздней кожной порфирии".
В последние годы обращено внимание на то обстоятельство, что у больных порфирией часто обнаруживается сахарная болезнь. Возможно, порфирия предрасполагает к развитию сахарной болезни, однако это еще нуждается в подтверждении, поскольку биохимическая связь между ними не обнаружена. Преобладающая часть порфиринов попадает в организм с пищей, а оттуда переходит в печень, которая превращает их в копропорфирины.
Порфирия, искусственно воспроизведенная у животных введением различных веществ (барбитуратов и других веществ), помогла изучить закономерности наследования нарушений порфиринового обмена. Разработаны широко доступные методы определения порфиринов, что облегчает диагностирование болезни. Некоторые болезни печени, и особенно хронический алкоголизм, тоже ведут к порфирии. Очевидно, и здесь причиной являются изъяны в работе ферментов, окисляющих порфириногены. Но это не врожденные ошибки обмена веществ, а злостные (благоприобретенные алкоголиками) нарушения работы печени.
Гемолитическая анемия обусловливается повышенным распадом эритроцитов. Она может быть врожденной или благоприобретенной. Мы остановимся на врожденной форме, в основе которой лежит ошибка обмена веществ. Этой болезнью страдают десятки миллионов людей от Тихого океана до Атлантики, в тропиках и субтропиках Старого Света. Болезнь выражается желтухой, малокровием, увеличением селезенки и печени (не всегда). Иногда она носит доброкачественный характер, и больные, по меткому выражению французского врача Видаля, "больше желтушны, чем больны". Но в ряде случаев могут возникать печеночные колики, язвы на голени, кровотечения. Развитие больных детей иногда задерживается, череп, нос, уши принимают неправильную форму.
В основе указанных явлений лежит повышенный распад эритроцитов. Выходящий из них гемоглобин разрушается главным образом в печени, однако распад его может происходить во всех других органах, где свободный гемоглобин выходит за пределы кровеносной системы. Сначала разрывается связь между порфириновыми кольцами в молекуле гемоглобина, и образуется пигмент зеленого цвета - вердоглобин. Затем из порфирина возникает (в основном в печени) соединение зеленого цвета - билирубин; у больных этот пигмент поступает в кровь в повышенных количествах. В еще больших количествах билирубин поступает в кишечник, где из него образуется сначала бесцветный уробилиноген, а затем желто-коричневый уробилин. Здоровый организм справляется с тем количеством уробилина, которое всасывается из кишечника в кровь, а оттуда переходит в мочу. Но организм больного гемолитической желтухой наводняется таким количеством уробилина, что он накапливается в крови (уробилинемия) и отсюда поступает в больших количествах в мочу (уробилинурия). Кал окрашивается в темно-коричневый цвет из-за перегрузки уробилином. Распад происходит главным образом в селезенке, что ведет к ее увеличению. На долю печени приходится перегрузка, увеличивается количество билирубина, который спообствует образованию камней в желчном пузыре. Такова картина этой болезни. Часто больным ставят диагноз: гепатит, холецистит, цирроз печени. Это ошибка. Несмотря на некоторое увеличение печени, она работает нормально, больные не страдают отсутствием аппетита или желудочно-кишечными расстройствами. Самочувствие их обычно не ухудшается. Такое относительное благополучие характерно для врожденной гемолитической анемии, тогда как приобретенная (вследствие инфекций, охлаждения, приема некоторых лекарственных веществ и ядов) протекает гораздо острее и болезненнее.
Чем объяснить нестойкость эритроцитов при этой болезни? В чем лежит ошибка обмена веществ? В эритроцитах восстановление окисленного глютатиона катализирует глютатионредуктаза, при непременном участии НАДФ-Н2. Без вмешательства этого вещества окисленный глютатион не может присоединить атомы водорода, т. е. восстановиться. На первом этапе превращений глюкозы в эритроците происходит ее окисление (вернее, окисление глюкозо-6-фосфата) в 6-фосфоглюконовую кислоту при участии глюкозо-6-фосфатдегидрогеназы, присутствие которой в эритроцитах было открыто более 90 лет назад. Коферментом глюкозо-6-фосфатдегидрогеназы является НАДФ-Н2. Без восстановленной формы глютатиона эритроцит обойтись не может и гибнет, что и происходит в отсутствие глюкозо-6-фосфатдегидрогеназы или при резком снижении активности этого фермента. Наследственный дефект фермента обнаруживается только в стареющих эритроцитах и тромбоцитах. Очевидно, действие мутации сводится к понижению устойчивости фермента. Интересно, что организм стремится как бы компенсировать эту ошибку обмена веществ усиленной выработкой глютатионредуктазы, так как в эритроцитах больных гемолитической анемией всегда наблюдается повышенная активность этого фермента.
Наследственный дефект, очевидно, заключается не в изменении строения самой молекулы фермента. Это было установлено специальными исследованиями, в которых фермент выделили из эритроцитов здоровых людей и больных гемолитической анемией. Сравнение показало, что ферменты ничем не отличаются друг от друга. Остается предположить, что ошибка обмена веществ в этом случае заключается в отсутствии в "больных" эритроцитах активатора глюкозо-6-фосфатдегидрогеяазы. Результаты некоторых исследований подтверждают это.
Гемолитическая болезнь, сопровождающаяся рвотой, лихорадкой, головокружением, желтухой и гемоглобинурией, особенно резко выраженная у мужчин, наблюдается после поедания конских бобов, особенно сырых. Эту непереносимость к употреблению в пищу конских бобов ("Вициа фава") называют фавизмом. В Ираке фавизм носит название багдадской весенней анемии. Механизм развития гемолитической болезни при фавизме, а также после принятия некоторых противомалярийных препаратов (примахин), сульфаниламидов, фенацетина, ацетанилина и других имеет своей исходной точкой наследственный дефект, наследуемый по доминантному типу. Эта наследственная ошибка обмена веществ обусловливает пониженную активность глюкозо-б-фосфатдегидрогеназы в стареющих эритроцитах. Необходимо отметить, что некоторые новейшие исследования позволяют высказать предположение, что изменение активности этого фермента, возможно, является проявлением неспецифического механизма своеобразной компенсации.
После того как была выяснена химическая природа болезни, ученые обратили внимание, что она особенно распространена в малярийном поясе Средиземноморья. Оказалось, что обладатели гена пониженной активности глюкозо-6-фосфатдегидрогеназы значительно меньше заражаются плазмодием малярии - мешает наследственный дефект в биохимии эритроцитов. Было установлено, что возбудители малярии нуждаются в больших количествах восстановленного глютатиона. Но его-то как раз и нет в эритроцитах больных. Таким образом, на протяжении веков наследственно передается мутация, безусловно вредная для организма человека, но этой ценой завоевывается устойчивость к еще большему врагу - малярии.
С эволюционной точки зрения, мутационные изменения, ведущие к образованию молекул, недоступных малярийному плазмодию, несомненно прогрессивны. Мутации, ведущие к появлению многих форм гемоглобиновой молекулы или изменяющие биохимию эритроцита, как в случае с наследственным дефектом глюкозо-6-фосфатде-гидрогеназы, ведут к наследственному полиморфизму (многоформности). Этот полиморфизм называют сбалансированным, когда гетерозиготная форма более жизнеспособна, чем обе гомозиготные формы; благодаря этому сотни миллионов людей выстояли перед натиском плазмодия в малярийном поясе.
Для лечения наследственной гемолитической анемии применяют гормональные препараты (преднизолон и др.) в течение длительного времени, хотя такое лечение более эффективно в случаях приобретенной болезни. Лучшие результаты дает хирургическое лечение - удаление селезенки, к которому прибегают, если обычное лечение (гигиенический режим, отдых, витамины, общеукрепляющие средства) не дает результатов.
Семейный характер носит и очень близкая к врожденной гемолитической анемии так называемая овально-клеточная анемия, при которой в крови обнаруживают эритроциты эллипсоидной формы (лептоциты), селезенка увеличена. Встречается и такая форма. анемии, при которой благодаря врожденной аномалии ферментов диаметр эритроцитов заметно увеличен.
Нарушение свертываемости крови. Как уже говорилось, свертывание крови - сложный процесс, протекающий пофазно.
I фаза: выделение из кровяных пластинок (один из видов клеток крови), обладающих способностью склеиваться друг с другом и образовывать тромб, тромбопластина. Если в силу каких-либо болезненных причин усиливается способность кровяных пластинок склеиваться, в кровяном русле могут образоваться тромбы.
II фаза: превращение протромбина (всегда присутствующее в крови белковое вещество) под воздействием выделившегося тромбопластина в активный фермент тромбин.
III фаза: превращение растворенного в крови белка фибриногена в нерастворимый фибрин под влиянием тромбина. Из нитей и сгустков фибрина создается основа тромба, закупоривающего сосуд.
В крови, как правило, готового тромбина нет. У здорового человека в ответ на появление небольших количеств тромбина сразу начинается защитная реакция. При помощи специального рефлекса организм защищает себя от тромбина - в кровь поступают противосвертывающие вещества (гепарин и др.). Больше всего гепарина в тканях печени и легких.
Пока в организме сохраняется противосвертывающий рефлекс, небольшие количества тромбина не вызывают свертывания крови. При атеросклерозе, характеризующемся, как известно, изменением стенок сосудов, чувствительность к тромбину нередко снижена. Вследствие этого защитный рефлекс не возникает. Противосвертывающие вещества не выделяются, возможность образования тромбов увеличивается.
Перейдем теперь к наследственным болезням свертывания крови. Их немало, но мы остановимся на тех, молекулярные основы которых более или менее выяснены.
Болезни, связанные со свертыванием крови, вызываются наследственным дефектом во многих случаях. Кровяная пластинка - тромбоцит представляет собой целую биохимическую лабораторию, в работе которой могут встречаться неполадки. Одна из таких неполадок носит врожденный характер. При этом кровяные пластинки, образующиеся в костном мозгу, никак не могут "отвязаться" от своих родителей (мегакариоцитов) и выйти в кровь. В результате возникает повышенная кровоточивость (одна из двух форм болезни Верльгофа) вследствие не достатка кровяных пластинок в крови.
Есть и другой вид наследственно-семейной кровоточивости - болезнь Гланцмана, механизм которой разгадали химики.
Казалось бы, что общего между сердечной мышцей и кровяной пластинкой? Вспомним, что сокращение сердечной мышцы осуществляется благодаря белку актомиозину при обязательном участии АТФ и АДФ. Тот же актомиозин обнаружили и в кровяной пластинке наряду с АТФ и АДФ. Ошибка природы здесь сказывается в резкой нехватке этих энергетических ресурсов. Впрыскиванием АТФ можно исправлять эту ошибку.
Приведем еще несколько болезней свертывания крови. Известно редчайшее заболевание, очевидно, рецессивного типа, связанное с недостатком протромбина. В литературе указаны всего три случая, в том числе у двух братьев. Оба брата показали удлиненное протромбиновое время, которое у одного из них удалось сократить применяя витамин К. Описаны десятки случаев другого наследственного заболевания - врожденного, полного или относительного недостатка фактора V. В ряде случаев родители больных детей были кровными родственниками. Это заболевание встречается среди обоих полов. У девушек и женщин оно служит причиной обильных месячных кровотечений, ведущих к анемии. Хотя царапины и уколы у таких больных обычно не кровоточат, но вообще они отличаются сильной кровоточивостью при ранениях.
Известно, что недостаток фактора VII тоже является причиной наследственного заболевания аутосомно-рецессивного типа, причем у гомозиготов проявляется тяжелой кровоточивостью, а у гетерозиготов очень слабо. Известно менее 10 случаев этого заболевания. Ошибка обмена, очевидно, заключается в так называемой бета-глобулиновой фракции белков сыворотки крови, поскольку фактор VII относится именно к этим белкам.
Не так давно было обнаружено аутосомно-рецессивное заболевание, связанное с недостатком фактора Стюарта. Характерен случай с мужем и женой - кровными родственниками, которые имели 12 детей. Одна половина из них была практически здоровыми, а у второй отмечалась повышенная (но не катастрофически) кровоточивость.
Наиболее распространенным и хорошо известным заболеванием этой группы является гемофилия А.
Место нарушения обмена в этом наследственном заболевании точно не установлено. Принято считать, что у гемофиликов содержится недостаточно антигемофилического глобулина. Возможно также, что определенную роль играет здесь дефект вещества, оказывающего подавляющее (ингибирующее) действие на свертывание. Болезнь обнаруживается в раннем детстве. Характеризуется сильной кровоточивостью, частыми кровоизлияниями в суставы, тяжелыми кровотечениями после ничтожных травм. Заболевание в основном затрагивает мальчиков. Характерна фазовость в устойчивости и восприимчивости к травмам. Кровотечение наступает не сразу после травмы. Средняя продолжительность жизни людей, страдающих этой болезнью, от 16 до 22 лет.
В гемофилии В (болезнь Кристмаса), похожей на это заболевание, место ошибки обмена заключается в недостатке фактора IX, содержание которого в крови снижено в 15-40 раз против нормы. Эта врожденная болезнь (наследование, связанное с полом*) хорошо изучена на 11 поколениях одной швейцарской семьи, в которой нашли 55 больных гемофилией на 3072 члена семьи. Средняя продолжительность жизни больного 22 года. Различить гемофилию А от гемофилии В можно по тому, что смесь равных частей крови больных этими болезнями свертывается нормально, а в отдельности ненормально.
*(Напомним, что наследственный дефект, передающийся в зависимости от пола, в генетике называют сцепленным с полом.)
Умеренной кровоточивостью отличается наследственная болезнь аутосомно-рецессивного типа, обозначаемая как дефект предшественника тромбопластина плазмы крови. Для нее характерно удлиненное время свертывания и ненормальное потребление протромбина. Иногда кровоточивость принимает серьезные масштабы. Болезнь распространена неравномерно: она, например, сравнительно часто встречается в Нью-Йорке и очень редко в Лондоне. Разновидность этого заболевания обнаружили у некоего Хагемана и так назвали его "дефект фактора Хагемана".
Оба эти заболевания отличаются особым поведением крови в лаборатории. Обычно при контакте с поверхностью стекла (стеклянной посуды) кровь свертывается, а при указанных заболеваниях - не свертывается (не прилипает к поверхности стекла). Считается, что дефект Хагемана - болезнь аутосомно-рецессивного типа.
Умеренной тяжестью отличается сосудистая гемофилия (хотя у женщин могут быть тяжелые кровотечения при менструации). Впервые это заболевание было описано Виллебрандом и носит поэтому его имя. В нем сочетается недостаток антигемофильного глобулина с дефектом капилляров. Болезнь наследуется по аутосомнодоминантному типу.
Некоторые из упомянутых выше дефектов свертывания крови могут сочетаться у одного и того же больного.
В рассказе о крови мы уже говорили о методе электрофореза - своеобразной скачке наперегонки белковых молекул. Этим методом белки плазмы крови можно в основном разделить на альбумины и альфа-, бета- и гамма-глобулины (к которым относится и фибриноген). С виду это однородные белки, к тому же несущие нагрузку, т. е. выполняющие в основном определенную функцию. Так вот удалось выяснить, что внутри такого белка имеются довольно существенные различия, которые могут передаваться из поколения в поколение "по воле генов".
Среди белков плазмы широко известны гамма-глобулины, защищающие наш организм от инфекций. Наследственно передаваемая недостаточность гамма-глобулинов ведет к предрасположению к инфекционным болезням. Такие люди легко по нескольку раз болеют свинкой или другими детскими болезнями, которыми нормальные люди повторно обычно уже не болеют. Подобная несопротивляемость некоторым болезням объясняется тем, что к гамма-глобулинам относятся антитела, играющие важную роль iB защите нашего тела от инфекции. Открытие этого вида ошибки белкового синтеза навело на мысль: нельзя ли использовать это явление в тех случаях, когда человеку необходимо пересадить кусочки чужих тканей? Известно, что главным препятствием к трансплантации служит несовместимость чужих тканей (другими словами, чужого белка) с тканями нашего тела. Организм борется против внедрения чужого белка, усиленно вырабатывая антитела (гамма-глобулины). Можно ли перед трансплантацией временно сделать попытку подавить производство гамма-глобулинов, заставить клетки нашего тела сделать ошибку в синтезе этих белков? Поиски в этом направлении ведутся.
Есть случаи, когда недостаток гамма-глобулинов является не наследственным, а благоприобретенным, как результат какой-либо инфекционной болезни*.
*(Все нормальные глобулины составляют большой класс белков, для которых характерна: общность конформации (все глобулины построены в основном из двух тяжелых и двух легких цепей, связанных дисульфидными мостиками) и функции (все глобулины являются антителами или принимают участие в реакциях иммунитета).)
Вообще различные глобулины, появляющиеся в сыворотке крови, могут являться зловещими предвестниками или признаками различных болезней. Их так и называют: "патологические" глобулины. Таковы ненормальные глобулины при злокачественной миеломной болезни или макро-глобулины при болезни Вальденстрема (злокачественное перерождение костного мозга). Миеломная болезнь затрагивает особые тканевые клетки, назначение которых вырабатывать гамма-глобулин. Клетки, хотя и продолжают синтезировать глобулин, но выпускают аномальные молекулы. Имеются веские основания считать, что причину в этих случаях надо искать в хромосомных нарушениях.
Сравнительно редко встречаются ненормальные бета-глобулины или их полное отсутствие, обусловленное гомозиготным аутосомным геном. Встречаются аномалии и в пределах альфа-глобулинов.
Известны случаи недостаточности (анальбуминемия) или ненормальности альбуминов плазмы крови, носящие наследственный характер. Очень редко встречается ошибка белкового синтеза, следствием которой является отсутствие фибриногена.
К ошибкам в химии крови очень условно можно отнести акаталазию и гипофосфатазию.
В организме в процессах окисления образуются перекиси. Под влиянием фермента кагалазы осуществляется распад перекиси водорода на воду и молекулярный кислород. Каталаза играет защитную роль, предохраняя организм от ядовитого действия перекиси. Этот фермент широко распространен в организме. Им особенно богаты эритроциты и печень.
20 лет назад японский ларинголог Такахара обнаружил, что кровь оперированной им пациентки при прибавлении капли перекиси водорода немедленно темнела без газообразования. (В крови здорового человека после добавления капли перекиси сейчас же образуется газ, но окраска при этом не меняется.) Оказалось, что кровь оперированной (и нескольких членов ее семейства) не содержала каталазы. Позднейшие исследования показали, что гипокаталаземия широко распространена в Японии (в других странах она пока не обнаружена). Частота ее составляет приблизительно один случай на 1000 человек.
В Японии, как известно, совершаются браки между кровными родственниками. Поэтому там распространена акаталазия, наследуемая аутосомно-рецессивно, причем у гетерозиготов обнаруживается пониженная активность каталазы крови - гипокаталаземия. Болезнь очень часто ничем не проявляется. Однако заболевания полости рта протекают очень тяжело, с гангреной, выпадением зубов и поражением челюстей. Вероятнее всего, что при заболеваниях полости рта бактерии, населяющие ее в больших количествах, вырабатывают перекись водорода, которая разрушает ткани. Возможно, что перекись водорода разрушает структурные и ферментные белки полости рта, окисляя их сульфгидрильные (серусодержащие) группы. Ошибка обмена, выражающаяся в нарушении синтеза каталазы, наблюдается также у некоторых пород собак и морских свинок.
При этом заболевании необходима строгая профилактика полости рта. Лечение гангренозного воспаления десен ведут при помощи антибиотиков, удаления зубов и оперативного вмешательства. Неплохие результаты дает переливание цельной крови, содержащей каталазу.
Совсем недавно установлено, что случаи трисомии могут не отражаться на свойствах 15 ферментов крови. Рассмотрим другую ошибку химии крови - гипофосфатазию.
К фосфатазам относят ферменты, отщепляющие фосфорную кислрту из ее соединений с органическими веществами. Известно около двух десятков различных фосфатаз. В данном случае нас интересует щелочная костная фосфатаза, которая, освобождая фосфорную кислоту из ее органических соединений (с глюкозой), способствует отложению в костной ткани фосфата кальция. Главная, но не единственная особенность гипофосфатазин - пониженная активность щелочной фосфатазы. Удобнее всего определять активность этого фермента в сыворотке крови. Удалось установить, что в ряде случаев она сильно понижена в костях, хрящах, зубах, печени, почках. Это характерное проявление ошибки обмена веществ при гипофосфатазии. Имеются и другие дефекты, в частности появление фосфоэтаноламипа в моче, а нередко и повышение содержания кальция в крови. Эти биохимические нарушения сочетаются с серьезными костными изменениями рахитического типа, обусловленными дефектами костеобразования. Болезнь можно обнаружить как в детском возрасте, так и у взрослых.
Фосфоэтаноламин не входит в состав мочи здоровых людей - это нормальная составная часть мозга. Как объяснить появление фосфоэтаноламина в моче при гипофосфатазии? Возможно, что это основной субстрат для костной щелочной фосфатазы. И наследственное блокирование реакции отщепления фосфорной кислоты от этого соединения служит причиной появления неиспользованного фосфоэтаноламина в моче. Но это предположение нуждается еще в доказательствах. Возможно, что фосфоэтаноламин играет роль в оссификации костей. Но и это только предположение. Ясно во всяком случае, что щелочная фосфатаза необходима для нормального костеобразования.
Для лечения больных были предложены витамин Д и кортизон. Но так как результаты оказались противоречивыми, можно считать, что методы лечения этого заболевания еще не разработаны. Болезнь наследуется по аутосомно-рецессивному типу. В литературе описано несколько десятков случаев.
В последнее время некоторые ученые считают, что ошибка обмена веществ при гипофосфатазии затрагивает целый ряд ферментных систем и особенно хондроитинсерную кислоту, которая играет важную роль в самом начале костеобразования.
Приведем еще два примера, иллюстрирующих огромную важность наследственных факторов крови.
Мы уже упоминали об особых белках - антигенах. Такие антигены (А и В) содержатся в эритроцитах. Именно они обусловливают принадлежность человека к одной из четырех основных групп крови. Группы крови передаются по наследству. Они формируются одной парой генов, "по воле" которых кровь содержит антиген А или антиген В, или оба вместе, или совсем не содержит их. Четыре возможности - четыре группы крови: I (О) - не содержащая совсем антигенов, II (А), III (В) и IV(AB). Группу крови очень важно знать, в первую очередь для переливания крови.
Лучше всего переливать больному кровь одноименной группы. Но, кроме того, можно переливать кровь доноров второй группы - больным, имеющим вторую и четвертую группы, третьей группы - третьей или четвертой группам, четвертой группы - только четвертой же группе, а кровь первой группы - всем группам. Нарушение этих правил ведет к тому, что эритроциты в чужеродной сыворотке крови склеиваются в комочки, а затем растворяются - гемолизируются, что может повести к гибели человека.
300 лет назад французский хирург Дени впервые перелил больному человеку кровь ягненка. Больной быстро поправился. Теперь-то мы знаем, что это было чистой случайностью. И, действительно, дальнейшие переливания чужеродной крови кончались катастрофой. О переливании крови в то время говорили так: "Для этой операции надо трех баранов: одного, от которого переливают, другого, которому переливают, и третьего, который переливает". Переливание крови запретили, но идея его не погибла. В наше время только в Советском Союзе ежегодно производят два миллиона успешных переливаний крови.
Знание групп крови используется еще для многих целей (определение отцовства, раскрытие преступлений ит. д.).
Но возвратимся к вопросу об антигенах крови. Еще 30 лет тому назад было показано, что эритроциты обезьян макак-резусов и людей (приблизительно 85%) содержат антиген, обусловливающий образование комочков (агглютинацию) при смешивании с сывороткой других животных. Этот "резус-фактор" отсутствует у 15% людей (возможно, вследствие мутации, приведшей к замене одной аминокислоты на другую в молекуле резус-фактора). На состояние здоровья наличие резус-фактора (резус-положительные люди) или отсутствие его совершенно не влияет. Образование резус-фактора вызывают нормальные гены. Но анализ крови на резус-фактор обязателен и перед переливанием крови, и перед беременностью во избежание тяжелых последствий. Ведь резус-фактор - антиген, а с антигенами шутить нельзя. Мы уже знаем, что они вызывают образование антител. Что произойдет, если резус-фактор плода окажется чужеродным белком для организма матери? А это может случиться, если отец передаст ребенку ген, определяющий резус-фактор (мать резус-отрицательна). В этом случае эритроциты плода могут вызвать цепь таких реакций, которые обусловят тяжелое заболевание ребенка.
В заключение отметим, что число наследственных болезней крови и кроветворных органов, изученных в той или иной степени, приближается к 100.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'