Межуточный обмен
Организм человека представляет сложное сообщество клеток. Маленькое хозяйство клетки удивительное по сложности и устройству*, совокупность совершенно необычных, еще не поддающихся полностью воспроизводству рукой человека интереснейших химических превращений, с которыми постараемся ознакомиться в общих чертах.
*(В простой бактериальной клетке можно обнаружить 2000 различных белков и 200 молекул ДНК. А каждая клетка нашего тела содержит их в 100 раз больше.)
Мы уже говорили о клеточных оболочках - мембранах, которые наделены ферментативной активностью и препятствуют свободному проникновению растворенных веществ. Более того, они могут переносить по своему выбору те или иные вещества внутрь органеллы*. А в органеллах содержится большая часть многочисленных ферментов клетки. Поэтому все химические превращения протекают в клетке не хаотически, а в строго определенных местах. Так, например, митохондрии содержат в себе ферменты и вырабатывают энергию для нужд клетки**. Более мелкие тельца - рибосомы - органеллы, поставляющие белки и содержащие все ферменты, необходимые для синтеза этих важнейших веществ.
*(Внимание биологов в настоящее время приковано ко многим "темным местам" в поведении мембран. А оно на редкость двойственно: мембраны изолируют клетку, наряду с этим обеспечивают сосуществование с другими клетками. Не раскрып тайны мембран, нельзя понять, как клетка согласовывает свои действия с тем, что происходит вокруг нее, как она реагирует на сигналы, поступающие из соседних клеток, как клетки участвуют в построении высших организмов. Раскрытие химической сущности гена - замечательное открытие, но и оно проще, чем механизм действия клеточной мембраны. По образному выражению лауреата Нобелевской премии французского биолога Моно, в генетическом коде была раскрыта связь "в одном измерении" между линейными полимерами - нуклеиновыми кислотами и белками. Ну, а в клеточной мембране, все это надо выяснить в двух или трех измерениях, да еще в усложненном виде.)
**(По новейшим данным, митохондрии содержат ДНК (в меньшем количестве, чем ядра клеток) и могут самостоятельно синтезировать некоторые белки. Роль митохондрий в жизни клетки настолько велика, что уже родилась новая область науки "митохондриология", успевшая установить, например, заметные различия в химическом составе и наборе ферментов обеих оболочек митохондрии.)
Напомню тут же, что строительным материалом для клеточных "сооружений" служат белки. Именно они обеспечивают структуру клетки, а следовательно, и всего нашего тела. Гиалоплазма, окружающая органеллы клетки, тоже представляет вещество, в котором ведущая роль принадлежит белкам, в том числе белкам-ферментам. А нуклеиновые кислоты осуществляют в клетке кибернетические функции. Ведь клетка содержит все необходимое для самовоспроизводства. В ДНК ядра половой клетки содержатся сведения не только о строении и обмене веществ подобной клетки, но и обо всем будущем развитии нашего тела. Ведь эта нуклеиновая кислота - материальный носитель наследственности. Ее важнейшее свойство - способность к самоповторению. А молекулы РНК - это разного типа орудия, участвующие в синтезе белка в клетке.
Нужен был гений Ломоносова и Лавуазье, напряженный труд многих поколений исследователей, установивших, что в любом живом организме происходит окисление органических веществ, в результате которого освобождается энергия. В наше время это знает каждый школьник. Все, что мы делаем - движемся, читаем, спим и т. д., - требует энергетических затрат. Разве могли бы без энергий сокращаться мышцы, работать пищеварительные железы, совершаться нервные процессы? Без энергетических затрат невозможна жизнь организма. Пища доставляет нам энергию солнечного света, которая превратилась в хлоропластах клеток растений в химическое горючее. Клетки нашего тела окисляют это горючее, и освобождающаяся при этом энергия используется Для приведения в действие различных клеточных механизмов. Энергия тратится сразу. В каждой клетке идет и накопление энергии, и ее трата. Клетка использует энергию химических связей. В энергетическом хозяйстве клетки особенное значение приобретают реакции окисления и восстановления.
Каждый из нас знает, что среди конечных продуктов распада, выделяемых нашим организмом, первое по количеству место занимают углекислый газ и вода. Это конечные продукты процессов окисления. Такие процессы осуществляются в клетке, в основном сводятся к отщеплению водорода (дегидрированию, отсюда название соответствующих ферментов: дегидразы или дегидрогеназы) и его переносу на другое вещество, которое при этом восстанавливается. Вещество, отдающее свой водород, называют донатором ("дона" - по-латыни подарок), а принимающее его - акцептором ("акцепто" - по-латыни принимаю).
Итак, окисление одного вещества всегда сопровождается восстановлением другого. Такие сопряженные реакции называют окислительно-восстановительными. Много ферментов клетки трудится над осуществлением окислительно-восстановительных процессов. Один из них действует на окисляющееся вещество, захватывает водород, а второй отнимает у него водород, чтобы затем передать третьему и т. д. Как известно, водород состоит из одного протона и одного электрона. Энергию протона клетка использовать не может. Ферменты уносят электрон с атома водорода и передают друг другу. Когда электрон перескакивает с фермента на фермент, излучается энергия. Приняв два электрона, кислород заряжается отрицательно. Потом он присоединяет два протона, оставшихся от водорода и свободно плавающих в клетке, и образует воду. В этом случае вода и углекислый газ - два конечных продукта клеточного дыхания.
Клетки и ткани нашего тела способны дышать с разной интенсивностью, которую ученые сумели измерить. Оказалось, например, что клетки почек потребляют в 20 раз, а сетчатки глаза даже в 30 раз больше кислорода, чем клетки кожи.
Окисление органических веществ в клетке обычно начинается с действия анаэробных дегидрогеназ, т. е. ферментов, переносящих водород к различным его "приемщикам" - акцепторам, но не к кислороду. Так, например, глюкозодегидрогеназа отщепляет водород от гексозофосфорной кислоты и передает его одному из флавиновых ("флавус" - по-латыни желтый) ферментов. Другие ферменты - цитохромы и цитохромоксидаза (или дыхательный фермент Варбурга) - переводят водород и кислород в активное состояние путем переноса электрона от водорода к кислороду. В небелковой части этих ферментов содержится железо. В окисленных цитохромах оно трехвалентно, в восстановленных цитохромах - двухвалентно. Присоединяя электрон, трехвалентное железо переходит в двухвалентное, и наоборот. Таким образом, цитохромы являются переносчиками электронов.
Цитохромоксидаза занимается окислением цитохромов. При этом одновременно восстанавливается небелковая часть (кофермент) этого фермента, и активированный водород соединяется кислородом с активированной цитохромоксидазой. Под конец восстановленная небелковая часть цитохромоксидазы окисляется кислородом с образованием воды. Таким образом, после долгих странствований водород окисляемого в клетке вещества попадает к главному акцептору - кислороду.
Роль переносчика водорода могут играть многие вещества, среди которых в первую очередь можно назвать аскорбиновую кислоту и глютатион (трипептид, содержащий серу), который входит в состав многих белков.
Но вернемся к энергии, которая постоянно нужна клетке для разных химических реакций, для механической или электрической работы (нервные импульсы). Такую энергию можно иметь постоянно, если имеются ее запасы. Клетка делает такие запасы. Энергия, которая выделяется при странствованиях электрона водорода, не пропадает. Клетка тотчас запасает ее в сложных фосфорных соединениях - молекулах аденозинтрифосфорной кислоты, или АТФ.
Синтез АТФ, который называют окислительным фосфорилированием, связан с процессами окисления, рождающими энергию. Его можно сравнить с механизмом зарядки аккумуляторов. Вырабатывают энергию, как уже говорилось выше, и запасают ее митохондрии. В них всегда присутствует предшественница АТФ - аденозиндифосфорная Кислота, или АДФ. В ее связях тоже запасена энергия. В АДФ всего две молекулы фосфорной Кислоты. Как только в митохондриях выделится энергия, АДФ использует еще одну молекулу фосфорной кислоты. На присоединение третьей молекулы к АДФ и, следовательно, преобразование АДФ в АТФ клетка затрачивает около минуты. За это время энергия аккумулируется в химической связи между третьей молекулой фосфорной кислоты и АДФ. Такая связь носит название "макроэргической", что означает "богатая энергией". Недаром более половины калорий, освобождающихся, например, при окислении глюкозы, запасается в макроэргической фосфорной связи АТФ, но только на время. АТФ - средство скорой помощи*. Ферменты доставляют молекулы АТФ всюду, где необходима энергия. АТФ с готовностью разрывает связь с одним остатком фосфорной кислоты, освобождая запасенную энергию. А количество этой энергии очень велико: отщепление остатка фосфорной кислоты происходит с выделением 12 ккал на грамм-молекулу освобожденного фосфора.
*(Организм располагает и другими подсобными источниками энергии. Эта трифосфонуклеиды. Их сокращенные названия - ГДФ, ГТФ, УДФ, УТФ, ЦДР, ЦТФ. По предположению А. Сент-Дьердьи, химическая энергия, накопленная в АТФ, может в клетке без промежуточного образования теплоты превращаться в электрическую энергию, используемую затем для различных "работ". Но доказательств этого пока нет.)
Клетка чутко реагирует на расход энергии. Как только образуются продукты распада АТФ, в митохондриях автоматически начинается синтез АТФ. Следовательно, потребность клетки в энергии и распад АТФ, отдающей накопленную в ней энергию, служат сигналом о необходимости производства энергии и, следовательно, окисления органических питательных веществ в митохондриях. Эти вещества - глюкоза, глицерин и жирные кислоты, аминокислоты - кровь и лимфа несут от кишечника к клеткам. Здесь они легко превращаются в излюбленный клеткой вид топлива - карбоновые кислоты, которые состоят из атомов углевода и водорода. За превращением водорода в митохондриях мы уже проследили. Обратим внимание на углерод, который проходит свой особый путь, кончающийся образованием конечного продукта - углекислого газа. Молекулы ферментов, расположенных в мембранах митохондрий, выполняют не только химическую, но и механическую работу. Митохондрии "дышат" под действием АТФ, они сокращаются и набухают, обеспечивая подачу воды и минеральных веществ.
АТФ занимает ведущее положение в энергетике организма. Запасенная в ней энергия с помощью ферментов фосфотрансфераз переключается с одного процесса обмена веществ на другой, а под действием фермента аденозинтрифосфатазы молекула АТФ расщепляется. Освобождающаяся при этом энергия может преобразоваться в другие виды энергии - механическую, тепловую, электрическую и т. д.
АТФ постоянно расходуется, и возобновление ее запасов является обязательным условием жизни организма. Такое возобновление идет в виде ресинтеза АТФ, происходящего в реакциях различного типа, важнейшей из которых является окислительное фосфорилирование.
На ресинтез АТФ организм затрачивает мало энергии, так как "занимает" для этого и передает на АТФ фосфатную группу из других богатых энергией соединений. Среди них главное место занимает креатинфосфат.
В поисках энергии организм может обращаться и к веществам, содержащим серу, используя ту особенность, что сера, присоединяясь к окисленному углеродному атому, образует богатые энергией связи. Такие связи встречаются в некоторых коферментах.
Большую роль в распаде (или синтезе) в клетках, играют циклы химических превращений. Особенно важен цикл трикарбоновых кислот, названный циклом Кребса по имени открывшего его ученого. Ключевую роль в этом цикле играет одна из трикарбоновых кислот - пировиноградная кислота, в которую могут превращаться углеводы и некоторые аминокислоты.
Но еще большую роль играет в этом цикле неутомимый путешественник - активная уксусная кислота (ацетилкофермент А). Она может возникать и из пировиноградной, и из жирных кислот, и даже из определенных аминокислот. Но главное в том, что эта активная кислота - ключевое вещество при распаде углеродного скелета различных органических веществ, а также строительная единица для их синтеза. Именно она завершает странствования углерода, превращаясь по ходу реакций цикла в две молекулы углекислого газа и две молекулы воды. Ниже мы еще вернемся к циклу Кребса, иллюстрируя его более конкретное "применение" в тканях нашего тела. И не будет большой ошибки, если мы будем называть его "дыхательным" циклом (рис. 30).
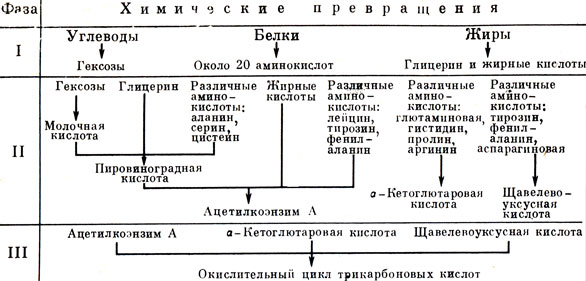
Рис. 30. Три фазы освобождения энергии в процессе обмена веществ
В химическом хозяйстве клетки большую роль играют не только реакции окисления. Отмечен особый тип реакций, заключающихся в переносе атомов или их группировок от одного соединения к другому. Это реакции переноса. Такова реакция переноса остатка фосфорной кислоты, в которой важнейшую роль играет АТФ, осуществляемая специальными ферментами - фосфоферазами. Таким же образом происходит и перенос остатка фосфорной кислоты при расщеплении и ресинтезе креатинфосфата, т. е. креатинофосфорной кислоты, химическая связь которой также играет роль аккумуляторов энергии в мышечной ткани. Но энергию этой связи мышечные клетки без помощи АТФ использовать не могут.
Интересна другая реакция, при которой фосфор переносится в мышечной ткани непосредственно с одного вещества на другое, минуя стадию образования фосфорной кислоты. В этой реакции не наблюдается выделения или поглощения энергии потому, что связи различных остатков молекул АТФ (а их три) по запасу энергии неодинаковы. Много энергии высвобождается только при разрыве богатых ею первых двух связей.
Большое значение в химических превращениях внутри клетки имеют и другие реакции переноса. Фактически клетка ведет свое химическое строительство так, как строят теперь дома, используя не отдельные кирпичи, а своеобразные блоки атомов. Этим очень упрощается строительство - биосинтез. Переносимые группы атомов, хотя и разнообразны (здесь активный метил, активный сульфат, содержащий серу, аминогруппы, включающие азот и остатки кислот, и другие соединения), но клетка легко разбирается в них. Реакции переноса метила называют трансметилированием, а реакции, в которых переносятся аминогруппы, - переаминированием (перенос аминогруппы).
Что же происходит в межуточном обмене (внутри клеток с продуктами распада белков (аминокислоты), углеводов (глюкоза), жиров (глицерин и жирные кислоты), которые кровь доставляет клеткам?
Ежесуточно в нашем теле кровь забирает из кишечника более 100 г различных аминокислот, образующихся при переваривании белков пищи. Сюда надо прибавить еще 20 г аминокислот, которые образуются при распаде собственных белков в клетках. Какова же судьба аминокислот в организме?
Мы неоднократно называли аминокислоты химическими кирпичиками, из которых состоит молекула белков. Вот для этой главной цели - построения необходимых ей белков - и использует клетка аминокислоты. Но аминокислоты используются не только для построения белков. Клетки сооружают из них многие другие азотистые небелковые вещества, иногда исключительно важные (некоторые гормоны). Наконец, клетки превращают аминокислоты в конечные азотистые продукты обмена веществ, вроде мочевины, которые выбрасываются из организма. Интересно, что концентрация аминокислот в клетке обычно выше, чем в наружной среде, откуда она их забирает.
Но если клетка - фабрика белков, не существуют ли в ней и заводы, готовящие их составные части - аминокислоты. Существуют, но с ограниченной номенклатурой продукции. Клетки могут строить и аминокислоты, но не все. Те аминокислоты, которые клетка не создает (во взрослом организме их восемь), мы считаем незаменимыми, так как вынуждены вносить их извне с пищей.
Итак, клетки восстанавливают белки, распавшиеся в процессе жизнедеятельности, за счет аминокислот. Но для молодого растущего организма этого недостаточно. Здесь аминокислоты идут на увеличение массы белков органом в связи с их ростом. Но для построения молекулы белка необходима энергия. Ее и поставляет вездесущий переносчик энергии - АТФ. Эта кислота соединяется с аминокислотой, чтобы передать ей свой запас энергии, т. е. активировать ее.
После активирования аминокислоты поступают в распоряжение нуклеиновой кислоты - главного действующего лица строительства белков.
Конечно, не все аминокислоты используются для синтеза белков. Немалая их часть претерпевает самые разнообразные превращения, чаще всего с образованием еще более простых веществ. В конце концов из них образуются аммиак, углекислый газ, вода и освобождается скрытая в их молекулах энергия.
Пути распада различных аминокислот неодинаковы. Но есть превращения, общие для многих аминокислот. Сюда относятся реакции дезаминирования, переаминирования и декарбоксилирования.
При дезаминировании, а по этому пути идет распад большей части аминокислот, каждая молекула окисляется, превращаясь в кетокислоту и аммиак.
При переаминировании общее количество аминокислот, вступивших в реакцию, не изменяется. Остатки аммиака, или аминогруппы, переносятся от аминокислот на кетокислоты. В результате возникают новые молекулы аминокислот, которые в свою очередь могут отдавать свои аминогруппы кетокислотам. Все происходит с участием особых ферментов. Получается своеобразная карусель, и на первый взгляд непонятно, для чего организму замкнутый круг химических превращений. На самом деле это не так. Клетки нашего тела используют сложную систему хотя бы для того, чтобы вовлечь аммиак в процессы обмена веществ, устранить образующийся при дезаминировании аммиак путем связывания его кетокислотой (в первую очередь кетоглютаровой). От образующейся при этом глютаминовой кислоты специальные ферменты - трансаминазы - переносят аминогруппы па другие кетокислоты с образованием соответствующих аминокислот. Реакции переаминирования поставляют почти половину аминогрупп, необходимых для синтеза мочевины - конечного продукта обмена белков.
Что касается декарбоксилирования, то оно заключается в отщеплении карбоксила кислотной группы в молекуле органической кислоты под действием декарбоксилаз. Этот путь превращения аминокислот в известной степени второстепенен. Но многие из образующихся протеиногенных аминов отличаются чрезвычайной физиологической активностью. Ничтожные количества этих веществ могут влиять на работу различных органов. Среди таких соединений важен гистамин. Гистамиы вызывает расширение мелких кровеносных сосудов и сужение более крупных, сокращение гладкой мускулатуры, повышает выделение соляной кислоты в желудке. Окситриптамин, который называют также серотонином, не только повышает кровяное давление, но способен оказывать противоречивое действие на центральную нервную систему, деятельность которой малые количества серотонина подавляют, а большие, наоборот, возбуждают.
Естественно, что и нуклеиновые кислоты подвергаются синтезу или распаду в клетках. Само название "нуклеиновые" (по-латыни "нуклеус" - ядро) указывает, что эти кислоты впервые были найдены в ядре клетки. Действительно, ядро содержит в основном ДНК, а также РНК, тогда как в цитоплазме клетки содержится только РНК.
Правильнее говорить не об одной РНК, а о многих, так как существует несколько типов РНК, о чем мы уже говорили выше.
Напомним, что цепь нуклеиновой кислоты состоит из связанных попеременно между собой молекул сахара и фосфорной кислоты. При этом у каждой молекулы сахара как бы подвешено одно пуриновое (аденин и гуанин) или пиримидиновое (цитозин и тимин) основание. Главное различие между ДНК и РНК в том, что сахар ДНК - это дезоксирибоза, а сахар РНК - рибоза, которая химически более уязвима, чем дезоксирибоза. Есть различия и в пиримидинах: у ДНК вместо тимина урацил.
Итак, сахар - фосфорная кислота - пурин или пиримидин - это основное звено цепи нуклеиновой кислоты. Его называют нуклеотидом. Если от нуклеотида отнять фосфорную кислоту, то он превращается в нуклеозид.
Клетка сначала заготовляет первичные кирпичики: пурины из осколков аминокислот, пиримидины из углекислого газа, аммиак из аспарагиновой аминокислоты, рибозу из продуктов углеводного обмена, а дезоксирибозу из рибозы.
Затем идет фабрикация крупных блоков - нуклеозидов и нуклеотидов, которые и в свободном виде играют важную роль в клетке как поставщики энергии.
И, наконец, клетка переходит к крупноблочному строительству "высотных" зданий - гигантских молекул нуклеиновых кислот. (Впрочем, молекулы РНК могут быть довольно небольших размеров). Строительство идет многообразными путями с вовлечением в работу множества ферментов. Как строительство, так и распад нуклеиновых кислот в клетке связан с синтезом и распадом белков.
Говоря о химическом хозяйстве клетки, мы стремились подчеркнуть ключевую роль нуклеиновых кислот. Ведь план строения, передающийся по наследству, заключен в молекулах ДНК, которые управляют синтезом белков-ферментов, а они в свою очередь управляют всеми химическими реакциями. Так клетки создают молекулы. Но при этом они могут ошибаться.
Остановимся на некоторых ошибках обмена аминокислот и пуринов.
Алкаптонурия, фенилкетонурия, тирозиноз, альбинизм - так назвал ошибки обмена веществ в начале нашего века Гэррод, впервые обративший на них внимание. Действительно, это ошибки, и притом врожденные. Классическим примером такого нарушения обмена веществ стала алкаптонурия, проявляющаяся в потемнении (иногда в почернении) мочи при длительном стоянии на воздухе. Откуда же появляется темное красящее вещество - алкаптон?
При распаде белков в клетках нашего тела образуются аминокислоты, в том числе тирозин и фенилаланин. Подвергаясь дальнейшим превращениям, эти аминокислоты образуют гомогентизиновую кислоту. В здоровом организме кислоту окисляет фермент оксидаза, содержащийся главным образом в печени. Разрывая химическое кольцо в молекуле гомогентизиновой кислоты, он переводит ее в малеилацетоуксусную кислоту (рис. 31). Действие оксидазы настолько молниеносно, что гомогентизиновая кислота просто "не успевает" появиться (а если и появится, ее быстро удаляют почки). Но когда обмен веществ протекает с некоторым отклонением от нормы, этот фермент не синтезируется, и гомогентизиновая кислота выделяется с мочой. При стоянии мочи кислота, особенно в присутствии щелочи, жадно присоединяет кислород и образует алкаптон (что означает "жадно поглощающий щелочь").
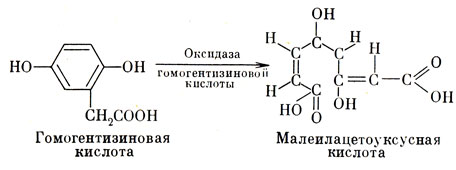
Рис. 31. Превращение гомогентизиновой кислоты
Темная, почти черная моча привлекает внимание. Не удивительно, что об этой болезни знали уже сотни лет назад. Но только Гэррод сумел распознать в ней наследственный дефект специального фермента, что было подтверждено уже в наши дни химическим исследованием печени больных. Осложнением болезни являются отложения темноокрашенных продуктов окисления гомогентизиновой кислоты в суставных хрящах и заболевания суставов.
Алкаптонурия - наследственная болезнь аутосомнорецессивного типа. Частота - порядка три-пять случаев на миллион, у мужчин в два раза чаще, чем у женщин. Больные нуждаются в лечении, но радикальных способов возмещения недостающего фермента пока не имеется.
Ограничение фенилаланина и тирозина в диете ведет к снижению выделения гомогентизиновой кислоты: оно допустимо только на очень короткие периоды времени, так как фенилаланин и тирозин - незаменимые аминокислоты. Имеются данные, что большие дозы аскорбиновой кислоты предупреждают отложение темного пигмента.
Гораздо неприятнее по своим последствиям другая ошибка обмена веществ наследственного характера. В этом случае из фенилаланина образуется не тирозин, а ввиду отсутствия или недостаточности специального фермента гидроксилазы фенилпировиноградная кислота, которая выделяется с мочой. Казалось бы, ошибка невелика. Дело в том, что обмен фенилаланина и в здоровом организме идет по двум путям: окисление в тирозин и окисление в фенилпировиноградную кислоту и т. д. (рис. 32). Закрыт первый путь, процесс может пойти по второму пути. Но этот путь чреват тяжелыми последствиями. Во-первых, пропускная способность его невелика. В результате в крови, спинномозговой жидкости и тканях накапливаются значительные количества фенилаланина, что веде1 в первые же месяцы жизни к тяжелому поражению центральной нервной системы, а в дальнейшем - к неизлечимому слабоумию. Во-вторых, блокада перехода фенилаланина в тирозин снижает ресурсы этой незаменимой аминокислоты. Тирозин используется организмом для многих целей, в частности для образования красящего вещества кожи и волос. (Этим объясняется посветление кожи и волос при этой аномалии.) В-третьих, при увеличенном производстве фенилпировиноградной кислоты задерживается деятельность одного из ферментов, участвующих в образовании таких гормонов, как катехоламины (адреналин и норадреналин). Эта наследственная болезнь также аутосомно-рецессивного типа. Известно 1000 случаев такой фенилкетонурии. Она мало распространена среди взрослых, главным образом вследствие гибели больных еще в детском возрасте.
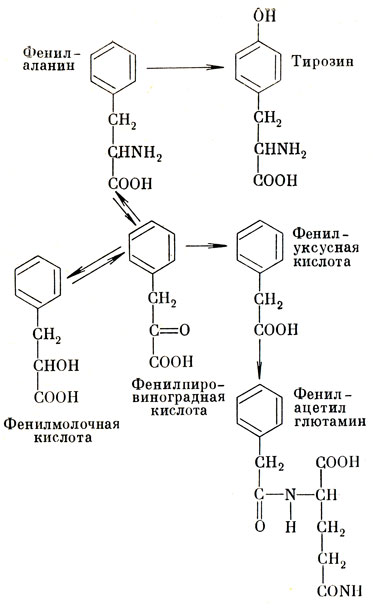
Рис. 32. Метаболические пути фенилаланина
Лечение необходимо проводить с самого раннего возраста, так как поражение ткани мозга уже необратимо. Установить болезнь можно при помощи простой пробы на ортооксифенилуксусную кислоту, которую больные выделяют вместе с мочой. К свежей моче прибавляют несколько капель 5%-ного раствора треххлористого железа и после появления осадка фосфатов добавляют еще три-четыре капли того же реактива. При наличии в моче ортооксифенилуксусной кислоты появляется оливково-зеленое окрашивание*.
*(В Англии широко распространен способ раннего диагноза: бумажку, пропитанную 5%-ным раствором FeCl3, кладут в пеленки новорожденных.)
Более сложно определение в крови фенилаланина, содержание которого у больных повышено в несколько десятков раз по сравнению с нормой. Лечение заключается в постоянном, но осторожном (при постоянном наблюдении за уровнем фенилаланина в крови) ограничении поступления фенилаланина с пищей. Необходимое количество калорий обеспечивают главным образом за счет углеводов и жиров.
Следует отметить, что наследственна неспособность организма синтезировать гидроксилазу фенилаланина, а не сама фенилкетонурия, которая является следствием этого дефекта.
Еще реже (фактически известен только один достоверный случай) проявляется ошибка обмена в отношении того же тирозина, носящая название "тирозиноза". В этом случае блокируется ферментный участок обмена после превращения тирозина в пара-оксифенил-пировиноградную кислоту, в результате чего резко повышается выделение этой кислоты и тирозина с мочой.
Если исходить из химической основы заболеваний, то к той же группе можно отнести и не так редко встречающийся альбинизм. Альбиносы - люди с совершенно белыми волосами и кожей и розово-красными глазами, что является следствием отсутствия красящего вещества - меланина. Есть много оснований предполагать, что у этих людей недостает ферментов, участвующих в окислении аминокислот тирозина или диоксифенилаланина - ДОФА, вернее, фермента тирозиназы, который окисляет тирозин и ускоряет дальнейшие превращения ДОФА (рис. 33, 34).
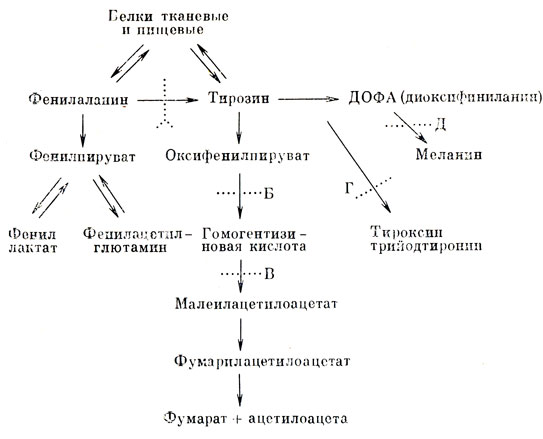
Рис. 33. Схема блокады метаболизма фенилаланина и тирозина
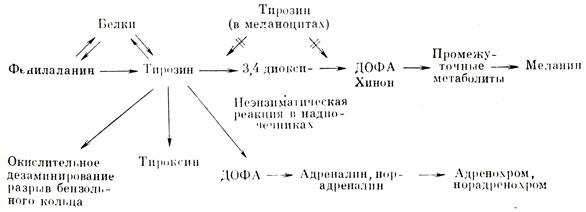
Рис. 34. Пути синтеза некоторых аминокислот при недостатке тирозиназы при альбинизме (по Фитцпатрик)
При окислении этих веществ у нормальных людей образуется меланин, а у альбиносов он не образуется. Пока еще не все причины развития альбинизма выяснены полностью. Это совершенно безобидное расстройство обмена. Можно назвать ряд выдающихся ученых-альбиносов. Альбинизм наследуется рецессивно. Частота - около пяти случаев на 100 тысяч человек.
При наследственной первичной гипероксалурии наблюдается повышенное выделение оксалатов с мочой и повышенное их образование; кристаллы оксалатов появляются в почках. Речь идет о наследственной болезни рецессивного типа, которая начинается приблизительно в возрасте одного-четырех лет, длится около четырех лет и кончается гибелью ребенка. Признаки болезни: повторные приступы почечных колик, гематурия и выход камней, состоящих из оксалата кальция. На рентгеновских снимках почти всегда можно найти камни в обеих почках. Болезнь необходимо отличать от обычной почечнокаменной болезни, при которой более чем в половине случаев камни тоже состоят из оксалатов. Многие ученые связывают эту благоприобретенную болезнь с обильным содержанием щавелевой кислоты в пище, хотя это нельзя считать доказанным. Что касается наследственной первичной гипероксалурии, то место ошибки обмена веществ пока не установлено. Теоретически возможен недостаток ферментативных превращений глиоксиловой кислоты, которая в организме является химическим предшественником щавелевой кислоты на путях обмена. Вероятно, здесь сказывается дефект соответствующего фермента, в результате чего почти вся глиоксиловая кислота переходит в щавелевую кислоту.
Аскорбиновая кислота тоже может превращаться в щавелевую кислоту, что несколько путает картину. Основное подозрение все же падает на простейшую аминокислоту - глицин. Почему? Во-первых, потому, что именно из глицина в организме образуется щавелевая кислота. Во-вторых, доказано, что прием больших количеств глицина повышает выделение щавелевой кислоты (рис. 35). Поэтому в питании больного необходимо сократить те продукты, которые содержат глицин, т. е. белки. Более эффективные способы лечения этой тяжелой болезни пока не разработаны. В литературе описано 14 случаев.
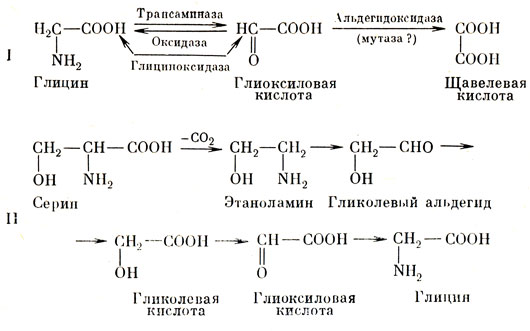
Рис. 35. Пути синтеза глиоксиловой кислоты в организме I - глициновый путь, II - путь через гликолевую кислоту
Лейциноз, или "болезнь кленового сиропа", характеризуется повышенными количествами лейцина, изолейцина и валина в моче. При этом заболевании моча имеет характерный запах кленового сиропа. Еще более типичным признаком является кетоацидурия, т. е. выделение кетокислот с мочой. Исследования привели к следующим результатам. В крови было обнаружено накопление упомянутых выше аминокислот. Анализ тканей показал, что эти аминокислоты нормально превращаются в кетокислоты. Задержка обнаружена на следующем этапе - окислительном декарбоксилировании кетокислот, которые в здоровом организме должны превращаться в простые кислоты - изомасляную и изовалериановую. В больном организме этого не происходит, очевидно, из-за недостатка соответствующего фермента.
Поскольку лейцин, изолейцин и валин являются разветвленными аминокислотами (в их молекулах цепочка углеродных атомов разветвлена), большинство ученых склонны считать это расстройство обмена аномалией "разветвленных" аминокислот. Но у таких больных повышается одновременно и содержание метионина в крови. А метионин - аминокислота с прямой неразветвленной цепью углеродных атомов.
Профилактика заключается в возможно раннем переводе на пищу с ограничением указанных аминокислот. Болезнь проявляется с первых дней жизни не только характерным запахом мочи, но и одновременной рвотой и мышечной слабостью с задержкой умственного развития. Болезнь встречается очень редко. В литературе описано несколько случаев, в том числе заболевание четырех из шести детей одной семьи. Эта аномалия в обмене нуждается в дальнейшем исследовании. Вина, вероятно, ложится на аутосомно-рецессивный ген.
Знаком ли читатель с запахом сушеного хмеля? Между тем ничего более определенного нельзя сказать о моче, содержащей аминокислоты: фенилаланин и метионин, а также другие кислоты. Эта ненормальность, очевидно, генного происхождения, обнаружена пока в одном только случае у лица, страдающего умственным недоразвитием и болезнью мышц.
Вообще лейцин - "коварная" аминокислота. Во-первых, она является особенно кетогенной. Что это означает? В организме лейцин подвергается таким превращениям, что все его углеродные атомы (а их в молекуле лейцина шесть) дают начало ацетоуксусной кислоте. А эта кислота нам хорошо знакома. Если ее восстановить, образуется бета-оксимасляная кислота, если же отнять карбоксил,- ацетон. Эти соединения, накапливаясь в крови и тканях, могут создать угрозу для сдвига реакции среды в кислую сторону, что чревато тяжелыми последствиями (вспомним сахарный диабет).
Во-вторых, совсем недавно открыт еще один генетический дефект на путях обмена лейцина. Под воздействием ферментов лейцин превращается в кетоизокапроновую кислоту, затем в изовалериановую, диметилкетоновую и т. д. до образования ацетоуксусной кислоты. У двух сибсов (детей от одной пары родителей независимо от их пола называют сибсами от английского слова "сибшип", что значит "братья-сестры") обнаружили огромное повышение в крови содержания изовалериановой кислоты - ИВК, тогда как содержание диметилкротоновой кислоты - ДМК - не менялось. Виновен во всем фермент дегидрогеназа, который должен переводить ИВК в ДМК. Аномалия эта аутосомно-рецессивного гена; она выражается тяжелыми приступами и умственной отсталостью.
Цистиноз - редкое заболевание детей и взрослых, наследующееся преимущественно по рецессивному типу. При этом малорастворимый цистин как бы выпадает из обмена и отлагается во всех органах и тканях. Это очень тяжелое врожденное заболевание, которое не надо смешивать с цистинурией. В литературе описано около 00 случаев цистиноза. При остром течении болезни дети гибнут на втором-третьем году жизни, но при хроническом могут дожить до юношеского возраста. Болезнь проявляется в потере аппетита, усиленной жажде, рвоте, повышенной температуре, светобоязни, задержке развития. Возникает картина тяжелого рахита. Характерный признак - повышенное выделение аминокислот с мочой (гипераминоацидурия), особенно лейцина, пролина и калина. Цистин откладывается в костном мозге, ретикуло-эндотелиальной системе, роговице и конъюнктиве глаза, что очень важно для установления диагноза. Недавно установлено, что нарушения химизма при цистинозе различны у детей и взрослых. Причина этого пока неясна.
Где происходит ошибка обмена веществ при цистинозе? Очевидно, на пути превращений цистина. Этот путь изучен хорошо: метионин, теряя один атом углерода, превращается в гомоцистеин, который через промежуточное соединение - цистатионин - передает серу серину, превращая его в цистеин. Две молекулы цистеина, легко уступая два водородных атома (и так же легко в случае необходимости их присоединяя), соединяются, образуя молекулу цистина, который должен окисляться в сульфат. В этих превращениях принимает участие ряд ферментов, но где именно происходит врожденная ошибка - в образовании или распаде цистина, пока установить не удалось.
Предложено несколько способов лечения цистиноза: все они дают некоторый эффект. Длительное применение витамина Е или витамина В12 способствует восста-новлению дисульфидных групп в молекуле цистина и лучшему использованию образовавшегося цистеина.
Борьбу с рахитом, при котором сильно понижено содержание фосфора в крови, ведут внутривенными вливаниями неорганического фосфора или с помощью больших доз витамина. Рекомендуется также применять большие дозы (50 мг в сутки) аденозинмонофосфата натрия как источника энергии для стимуляции белкового обмена.
Недалеко от "запаха кленового сиропа" ушло и название "синдром голубых пеленок". Так назвали аномалию обмена триптофана, биохимический дефект которого предположительно заключается в неправильности всасывания этой аминокислоты из кишечника в кровь. Почему же именно из кишечника? А потому что, когда таким больным (двум братьям из одной семьи) раствор триптофана вводили непосредственно в вену, то распад этой аминокислоты шел по таким же путям и с образованием тех же конечных продуктов, как и в нормальном организме. Наряду с этим всегда повышено содержание кальция в крови, причина чего еще не выяснена.
Гистидин в известной степени загадочная аминокислота. Во-первых, это единственная аминокислота, в составе которой имеется имидазольное ядро. Во-вторых, она резко отличает человека от всех животных, для которых гистидин - незаменимая аминокислота. Взрослый же человек может обходиться без гистидина, доставляемого с пищей. Возможно, что человеку помогают его извечные друзья-враги, в данном случае микробы, обитающие в кишечнике. Они могут синтезировать гистидин в количествах хотя и малых, но достаточных для обмена. Это только предположение. Можно допустить, что организм человека, его ткани тоже синтезируют гистидин.
Превращения гистидина в нашем теле достаточно изучены. Интересен ближайший химический родственник гистидина - гистамин, чрезвычайно активное вещество, о котором мы уже упоминали*. Но, пожалуй, главный путь ферментативного распада гистидина начинается с образования уроканиновой кислоты, которая подвергается дальнейшим превращениям. (Эта кислота впервые выделена была из мочи собаки.)
*(Совсем недавно ученые начали подозревать, что генетически обусловленное нарушение обмена гистамина лежит в основе наследственного ан-гионевротического отека.)
Повышение содержания гистидина в крови - крайне редкое явление (его можно назвать гистидинемией). Так же редко выделяется гистидин и в моче. И то it другое было обнаружено у двух сестер. Для выяснения механизма аномалии обеим девочкам дали чистый гистидин. Но даже и в этом случае в моче найти уроканиновую кислоту не удалось. Отсюда ясно, что блокаду обмена надо искать в самом начале пути - в дефекте того фермента, который перерабатывает гистидин в уроканиновую кислоту. Этот фермент носит название дезаминазы альфа-гистидина. Предполагается, что эта аномалия вызвана рецессивным геном, наследуемым гомозиготно.
В состав белков входят три аминокислоты, которые содержат серу: цистеин, цистин и метионин. Самая важная из них метионин. Это в полном смысле слова незаменимая для организма аминокислота. Метионин - неутомимый поставщик содержащейся в нем метильной группы, которую легко уступает другим соединениям. Если организм не обладает достаточным запасом таких подвижных метильных групп, это может тяжело отразиться на состоянии печени и почек. Метионин может с успехом заменять в нашем питании цистин и цистеин. Дело в том, что метионин легко переходит в цистеин и цистин по схеме: метионин - гомоцистеин - серии - цистатионин - гомосерин - цистеин.
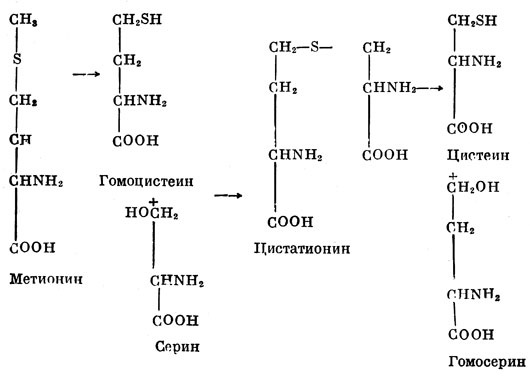
Цистеин и цистин, так легко и притом обратимо окисляясь и восстанавливаясь, переходят друг в друга, что это их свойство используют многие биологические регуляторы - ферменты и гормоны.
Одна из аномалий обмена этих серусодержащих кислот - цистинурия - выведение цистина с мочой (иногда 2 г в сутки). Хотя в моче одновременно появляются и другие аминокислоты, в частности аргинин, лизип, орнитин, проведенные исследования позволяют думать, что здесь имеется наследственный дефект всасывания главным образом цистина в извитых канальцах почек. Наследование этой аномалии обмена рецессивное.
Другое нарушение обмена серусодержащих кислот носит название цистатионурии. Блокада здесь состоит, очевидно, в дефекте фермента, переводящего цистатионин в гомосерин и цистин. Такую блокаду удалось вызвать экспериментально у животных. Наследование этого нарушения рецессивное. Известны всего три случая.
Важны для организма и аминокислоты - аргинин и цитруллин. Аргинин в известной степени незаменимая аминокислота, цитруллин вместе с аргининоянтарной кислотой и аргинином участвует в чрезвычайно важном для организма цикле синтеза конечного продукта распада аминокислот - мочевины.
Имеется предположение, что именно благодаря блокаде в этом цикле содержание цитруллина в моче и крови может сильно повыситься, как это наблюдалось у одного больного, родители которого были близкими родственниками. Эти явления сочетались с умственным недоразвитием и запоздалым ростом костей. Наследование рецессивное.
В редких случаях у братьев и сестер отмечалось умственное недоразвитие, сопровождавшееся повышением аргининоянтарной кислоты в крови и моче. Блокада предположительно происходит в цикле образования мочевины. Наследование аутосомно-рецессивное.
В иерархии аминокислот пролин и оксипролин занимают важные места. Это заменимые аминокислоты и их присутствие в пище человека необязательно. Правда, они являются как бы родоначальниками некоторых других важных аминокислот1. Известны несколько случаев расстройства обмена пролина с довольно тяжелыми клиническими проявлениями. Во всех случаях содержание пролипа в крови было повышено. Совсем недавно описаны случаи врожденной оксипролинемии. Причина нарушения - недостаточность фермента оксидазы, ведающего окислением оксипролина.
В ряде случаев все аминокислоты, содержащиеся в плазме крови членов одной и той же семьи, появляются в моче. Такая семейная аминоацидурия носит совершенно безобидный характер и зависит от дефекта обратного всасывания аминокислот в извитых канальцах почек. Наследование дефекта доминантное.
Но аминоацидурия далеко не всегда бывает безобидной. Она наблюдается и при синдроме де Тони-Фанкони, сопровождающейся рахитом и ацидозом, и при некоторых видах остеомаляции - размягчении костей. В обоих случаях наследование рецессивное. Проявляется аминоацидурия и при расстройствах других сторон обмена - галактоземии, болезни Вильсона и др.
Расстройства обмена аминокислот довольно часто приводят к задержке умственного развития. Из 25 аномалий обмена, приводящих к расстройству умственного развития, 15 приходится на долю аминокислот.
Конечные продукты распада аминокислот в организме - углекислота, вода, мочевина и аммиак. Аммиак очень ядовит, и его накопление в крови и тканях чревато тяжелыми последствиями. Поэтому органы нашего тела, в первую очередь печень, стараются обезвредить его. Главный способ обезвреживания аммиака - использование его для синтеза мочевины. Но есть и другие пути. В частности, почки используют аммиак для нейтрализации кислот: образуются аммонийные соли, которые выводятся с мочой.
Повышение содержания аммонийных солей в крови носит название гипераммониемии. Такая гипераммониемия наблюдалась, например, у трех детей с очень тяжелой болезнью печени (родители их были близкими родственниками). Причина - недостаточность ферментов, принимающих участие в синтезе мочевины. Наследование рецессивного типа.
Нуклеопротеиды пищи распадаются в желудочно-кишечном тракте на белок и нуклеиновую кислоту. Белок превращается как обычно. А нуклеиновая кислота распадается на мононуклеотиды при участии рибонуклеазы или дезоксирибопуклеазы. Ферменты фосфатаз кишечника расщепляют мопонуклеотиды на фосфорную кислоту и нуклеозид. Мононуклеотиды и нуклеозиды участвуют в построении нуклеиновых кислот в тканях. С чего начинается синтез РНК? Из глюкозо-6-фосфата через реакции окисления и декарбоксилирования образуется рибозо-5-фосфат. Последний является основанием, на котором синтезируется пуриновое основание. В его образовании принимает участие глютамин, глютаминовая и аспарагиновая кислота, глицин, угольный ангидрид, активированный АТФ и муравьиная кислота. Инозиновая кислота получает аминогруппу от глютамипа и превращается в тканях в адениловую и гуаниновую кислоты. Аспарагиновая кислота с карбонилфосфатом образует сначала карбамиласпарагиновую, затем оротовую кислоту - предшественницу всех пиримидиновых оснований. Оротовая кислота конденсируется с фосфорибозой и после декарбоксилирования превращается в уридиловую кислоту. Последняя превращается в цитидиловую кислоту. Биосинтез РНК был осуществлен С. Очоа. Синтез ДНК начинается с дезокси-рибозо-5-фосфата. Пуриновые нуклеотиды в ДНК синтезируются так же, как при синтезе РНК. Сходны и первые стадии синтеза пиримидиновых оснований до образования оротовой кислоты.
Уридиндезоксирибозил-5-фосфат, из которого образуется цитизиповое производное, возникает как промежуточное соединение из оротовой кислоты с дезоксирябозо-5-фосфатом. При участии фолиевой кислоты образуется тимидиновое производное.
Участвующие в синтезе ДНК мононуклеотиды сначала фосфорилируются с образованием трифосфорных соединений (АТФ, ГТФ, ЦТФ, ГУФ - содержащие дезоксирибозу). Необходимо небольшое количество ДНК в качестве затравки для синтеза ДНК из нуклеозидтрифосфатов. Затем двухполинуклеотидовая цепь ДНК расходится, и на каждой из цепей из нуклеозидтрифосфатов синтезируется новая ДНК, при участии фермента полимеразы. Распад нуклеиновых кислот в организме осуществляется под влиянием рибонуклеазы тканей. Нуклеиновые кислоты деполимеризуются до мононуклеотидов. Нуклеотидазы расщепляют мононуклеотиды на фосфорную кислоту и нуклеозиды. Последние подвергаются ферментативному распаду до азотистого основания и углевода. Азотистые основания дезаминируются под влиянием дезаминаз, причем дезаминирование может происходить на стадии пуклеотида, нуклеозида или свободного основания. Гипоксантин образуется при дезаминировании аденина, ксантин - при отщеплении аминогруппы от гуанина. Гипоксантин окисляется в ксантин, последний с помощью ксантиноксидазы окисляется до мочевой кислоты.
Подагра. Один из характерных признаков подагры - повышенное содержание мочевой кислоты, задержка выделения ее солей - уратов - с мочой и отложение в хрящах, суставах, коже и в других тканях. Иногда общее количество отложенных уратов может исчисляться килограммами!
Один из характерных признаков подагры - "тофи". Так называются отложения уратов в виде узелков на мочках ушей и в завитках ушных раковин, а также вокруг суставов и сухожилий, что вызывает боли и ограничивает их подвижность. Такая подагра развивается почти исключительно у пожилых мужчин. Очень часто поражаются почки, что может привести к гибели от болезни почек. При подагре содержание уратов в крови (в норме около 4 мг%) может повыситься в два-четыре раза, что обусловлено усиленным образованием уратов, а может быть, и пониженным выделением мочевой кислоты с мочой. Такое повышение часто наблюдается у родственников больных подагрой, которые заболевают подагрой чаще других. Наследственное предрасположение к подагре почти не отмечается у женщин, что, кстати, очень затрудняет установление наследственного характера болезни. Место нарушения обмена, ведущего к повышению уровня уратов, пока не установлено. Существуют предположения, подкрепленные соответствующими опытами (рис. 36).
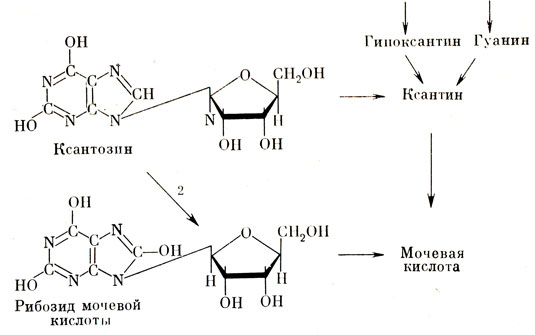
Рис. 36. Синтез мочевой кислоты через рибозид мочевой кислоты
Некоторые ученые видят причину подагры в повышенном образовании мочевой кислоты, а вот объяснить "причину этой причины" затрудняются. Может быть, наш организм подражает птицам, у которых гипоксантин окисляется в мочевую кислоту? Но почему организм вырабатывает избыточные количества? Где место ошибки? Возможно, в месте ферментативной выработки одного из продуктов распада нуклеиновых кислот - инозин-5-фос-фата, из которого легко образуется гипоксантин. А может быть, тормозятся какие-либо процессы распада мочевой кислоты. С другой стороны, задерживать мочевую кислоту в организме могут и почки. Но все же большинство ученых склонно искать объяснение в повышенном синтезе мочевой кислоты.
Картину нарушает то обстоятельство, что известен ряд болезней, сопровождающихся повышенным распадом нуклеопротеидов - основных источников мочевой кислоты. Такую подагру называют вторичной.
Подагру принято считать заболеванием аутосомнодоминантного типа, с неполным проявлением (около 20%) у мужчин и почти полным проявлением у женщин. Не исключается, что в основе его лежит расстройство действия многих генов одновременно. В последнее время делаются попытки связать повышенное содержание мочевой кислоты и инсулина в крови подагриков.
Большое значение для профилактики и лечения больных подагрой имеет пищевой режим. Из лекарственных препаратов, вызывающих усиление выделения уратов и их растворение в суставах, приносят пользу салицилаты, фенилбутазон, сульфинпиразон, пробенецид, кортикостероиды. Но каждый лекарственный препарат обладает разносторонним действием, и пользоваться ими можно только по предписанию врача.
Ксангинурия. Известен только один хорошо документированный случай этого редчайшего заболевания. Как и мочевая кислота, химическим предшественником которой в организме он является, ксантин относится к пуринам. Можно допустить, что при ксантинурии имеется дефект фермента, окисляющего ксантин в мочевую кислоту. Возможно также, что имеется и дефект работы почек, вследствие чего ксантин так быстро выделяется с мочой, что не успевает окисляться в мочевую кислоту. В силу той или иной причины (или обеих причин вместе) больной выделяет большие количества ксантина и образуются ксантиновые камни. В литературе описано более 30 случаев обнаружения ксантиновых камней у людей различного возраста, преимущественно у мужчин. Наследственность этой болезни пока достоверно не доказана. Хотя считается, что она обусловливается единичным аутосомнодоминантным геном. Лечение сводится к усиленному приему жидкостей, а также щелочей для установления щелочной реакции мочи. Интересно, что при ксантинурии резко понижается содержание мочевой кислоты в сыворотке крови и моче.
На одном из этапов обмена пуринов образуется оротовая кислота. В здоровом организме эта кислота при помощи фермента присоединяет фосфорную кислоту, а на следующем этапе подвергается воздействию фермента, отщепляющего от нее карбоксильную группу (рис. 37). При ошибке обмена веществ активность одного или двух ферментов нарушается, что приводит к выделению с мочой большого количества кристаллов оротовой кислоты и развитию тяжелой анемии. Болезнь была обнаружена у пятимесячного сына кровных родственников, у которых активность упомянутых ферментов оказалась пониженной (как, впрочем, у брата и сестры больного). Ребенка удалось вылечить гормонами коры надпочечников и введением смеси уридиловой и цитидиловой кислот, действующих на систему ферментов обмена оротовой кислоты.
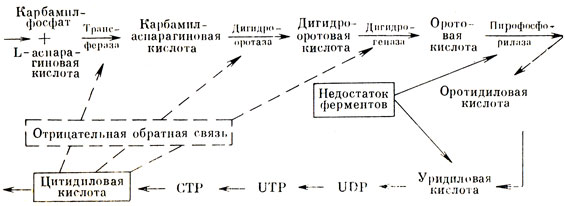
Рис. 37. Блокада метаболизма при оротоацидурии и механизм синтеза оротовой кислоты
Бета-аминоизобутиратацидурия сопровождается выделением с мочой ежесуточно 200-300 мг бета-аминоизомасляной кислоты. Эту кислоту нельзя отнести к группе аминокислот, составляющих молекулу белков, так как ее не смогли обнаружить ни в одном из изученных белков. Она может образоваться из пиримидинового основания - тимина - или из аминокислоты - валина.
Есть основания предполагать, что ферменты, участвующие в образовании бета-аминоизомасляной кислоты, не причастны к ее выделению с мочой. Скорее, здесь проявляется дефект ферментов, участвующих в ее дальнейших превращениях, которым обусловлена эта "болезнь" рецессивного типа. Слово "болезнь" взято в кавычки, потому что выделение этой кислоты - довольно широко наблюдающееся явление у здоровых людей. Правда, выделение бета-аминоизомасляной кислоты наблюдается в повышенных количествах при некоторых болезнях (лейкемия, туберкулез, болезни печени), но и здесь причину надо искать в повышенном распаде дезоксирибонуклеиновой кислоты*.
*(Известно, что мочевая кислота может образоваться из инозиновой кислоты, которая используется в нашем организме для синтеза РНК. В свою очередь в синтезе инозиновой кислоты принимают участие глицин, глютамин и аспарагиновая кислота. Но раз это так, мы вправе сделать вывод, что мочевая кислота может образовываться из аминокислот. Тогда нас не будет смущать то обстоятельство, что при подагре может не происходить усиленный распад РНК и ДНК, являющихся главным источником мочевой кислоты.)
Кроме того, возможны совпадения, поскольку и больные до болезни могли выделять бета-аминоизомасляную кислоту, что проходило незамеченным. Пол и диета не влияют на выделение этой кислоты. Дети до 5 лет чаще выделяют повышенные количества, чем взрослые: китайцы, японцы и таиландцы чаще, чем белое население США, Англии и Италии.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'