Молекулы-гиганты
В мире молекул есть свои карлики и свои великаны. Можно по праву говорить о гигантских молекулах, высокомолекулярных соединениях или полимерах, свойства которых настолько удивительны, что химию больших молекул можно считать областью науки, наиболее характерной для нашей эпохи. Наука и молекулах-гигантах, или полимерах, сливается с наукой о жизни, так как с природными полимерами связаны все жизненно важные процессы и происхождение жизни.
По современным представлениям, живые существа построены в основном из макромолекул. Но в чем принципиальное отличие гигантских молекул полимеров от малых молекул? Почему смесь из тысячи малых молекул не может заменить для живого организма макромолекулу, состоящую из тысячи малых молекул, соединенных друг с другом под действием процесса полимеризации?
Таких отличий очень много. Прежде всего смесь из малых молекул (представим себе тысячу сложенных вместе, но не соединенных, не связанных друг с другом кристалликов) не обладает той гибкостью и подвижностью, которая совершенно необходима для жизнедеятельности. Для своего существования организм должен обладать, с одной стороны, устойчивостью строения, с другой - достаточной гибкостью, чтобы быть чувствительным к внешним воздействиям и сопротивляться им в случае надобности. Этими свойствами смесь из малых молекул, как бы мы их ни расположили, не обладает. Столбик, сложенный из тысячи кристалликов, рассыпается от легкого толчка. Макромолекула, т. е. цепь из такого же количества малых молекул, противостоит подобным толчкам.
Живые организмы всегда индивидуальны. Они обладают особыми свойствами, присущими именно данному организму. Достаточно нам взглянуть друг на друга, чтобы убедиться в этом. Но дело здесь не только во внешних различиях. Кристаллики, которые мы уподобили малым молекулам, отличаются друг от друга по форме и размеру, но их химическое строение может быть совершенно одинаковым. Наоборот, организмы отличаются друг от друга не только внешне, но и по химическому строению. Эти отличия во многом определяются различием свойств тех полимеров, которые входят в состав организмов. Более того, свойства одних и тех же полимеров не только отличны у каждого организма, но могут меняться и "внутри" одного и того же организма. Кровь человека, например, помимо хорошо всем известного белка гемоглобина, придающего ей красный цвет, содержит и другие белки - альбумины. Совсем недавно установлено, что свойства этих полимеров различны не только у отдельных людей, но даже у одного и того же человека в разные моменты времени. Такой изменчивостью малые молекулы не обладают. Поваренная соль, например, входит в состав живых организмов, но ее свойства в организме каждого человека (и других живых существ, населяющих нашу планету) совершенно одинаковы.
Другими словами, у малых молекул отсутствует индивидуальность, а макромолекулы полимеров обладают индивидуальностью, специфичностью строения - свойством, очень важным для "построения" живых существ. Достаточно сказать, что все жизненно важные вещества обладают так называемой стереоспецифичностью. Только живая природа обладает способностью создавать такие вещества. Но несколько лет назад ученым удалось получить подобные полимеры искусственным путем и разгадать эту тайну природы.
Каждое живое существо нуждается для своей жизнедеятельности в энергии. Человек и животные черпают ее из пищи. Постоянный приток энергии извне необходим для поддержания температуры тела человека и теплокровных животных на определенном уровне. В животном организме постоянно (даже во время сна) работают сердце, легкие, кишечник и т. д., что также требует затраты энергии. Эта энергия получается при распаде веществ, которые попадают в организм с пищей. Запасенная в пищевых веществах химическая энергия превращается в механическую с одновременным освобождением теплоты.
Малые молекулы обычно бедны свободной энергией. Крупные молекулы и полимеры имеют большие запасы энергии. Только макромолекулы обладают способностью превращать химическую энергию в механическую и обратно и тем самым обеспечивают постоянную работу и воспроизведение клеток тела человека и животных.
Различие между малыми и гигантскими молекулами полимеров может проявляться и в другом. Химикам и биологам хорошо известно так называемое броуновское движение молекул. Правда, движение их можно прекратить путем резкого снижения температуры. Но при низкой температуре прекращаются и химические реакции. Тепловое же движение макромолекул не нарушает их свойств и не изменяет последовательности расположения звеньев в цепи. Это очень важное свойство, отличающее полимеры от малых молекул и имеющее существенное значение для процессов, которые протекают в живых организмах. Биохимики говорят, что такие макромолекулы обладают памятью.
"Запоминающая" молекула! Как необычно звучат эти слова. Макромолекулы могут "записать" информацию, "запомнить" и передать ее по наследству, и в этом состоит химический механизм процесса самовоспроизведения - авторепродукции.
Перечень особых свойств полимеров можно было бы продолжить, но мы еще вернемся к ним в соответствующих главах, запомним только следующее. Полимеры, образовавшиеся из молекул разных мономеров (в данном случае аминокислот), называют сополимерами. Полимеры, из которых в основном построены все живые организмы, называют биополимерами. Их превращения составляют материальную основу большинства биологических процессов. Помимо белков к биополимерам относятся нуклеиновые кислоты, фосфолипиды и полисахариды.
Любые белки, встречающиеся в природе, при разложении дают одни и те же химические соединения - аминокислоты. Известно двадцать аминокислот. Они входят в состав белкового сополимера, многократно повторяясь и сочетаясь друг с другом различным образом. Самая характерная особенность белковой молекулы - способ, при помощи которого отдельные аминокислоты связываются в ней друг с другом. Это так называемая пептидная связь.
Как представить себе эту связь? Дело в том, что аминокислоты являются одновременно и щелочами. Кислотную группу в частичке аминокислоты называют карбоксилом, щелочную - аминогруппой. Именно соединение карбоксила одной аминокислоты и аминогруппы другой и образует пептидную связь. Такое соединение именуют пептидом, а соединение многих молекул аминокислот - полипептидом.
Итак, основу белкового сополимера составляют полипептидные цепочки. Длина этих цепочек и их количество неодинаковы у различных белков. Количество аминокислотных звеньев, их соотношение и порядок чередования тоже различны. Важнейшее достижение последнего десятилетия заключается в том, что не только удалось выяснить химическое строение полипептидов, но и искусственно его воспроизвести. Синтезированные молекулы идентичны молекулам веществ, содержащимся в организме живых существ, и обладают их жизненно важными свойствами. Назовем и такие полимеры биополимерами.
Что общего между натуральным шелком, куском мяса, сыром и желатином? Они состоят из белков. Как различны, должно быть, эти белки! Но все они, да и любые другие белки, встречающиеся в природе, при разложении дают одни и те же химические соединения - аминокислоты.
Белковые молекулярные цепочки располагаются в пространстве различным образом. Они могут образовать спираль, свернуться в клубок, соединиться друг с другом более прочно или образовать менее компактную группу. Способ укладки молекулярных цепей определяет многие свойства белков. Способность такой цепочки свертываться или развертываться лежит в основе поведения протоплазмы живого вещества всех клеток, из которых состоит организм животного или растения. Чем это объясняется?
Аминокислотные остатки содержат активные химические группы - CO, SH, NH2, вступающие в разнообразные реакции с различными веществами. Если эти группы запрятаны в недрах белковой молекулы, она малоактивна. Но представим себе, что белковая молекула как бы выпустила эти химические "щупальца" наружу. Такая молекула находится во всеоружии своих химических средств, приведенных в состояние боевой готовности (рис. 8).
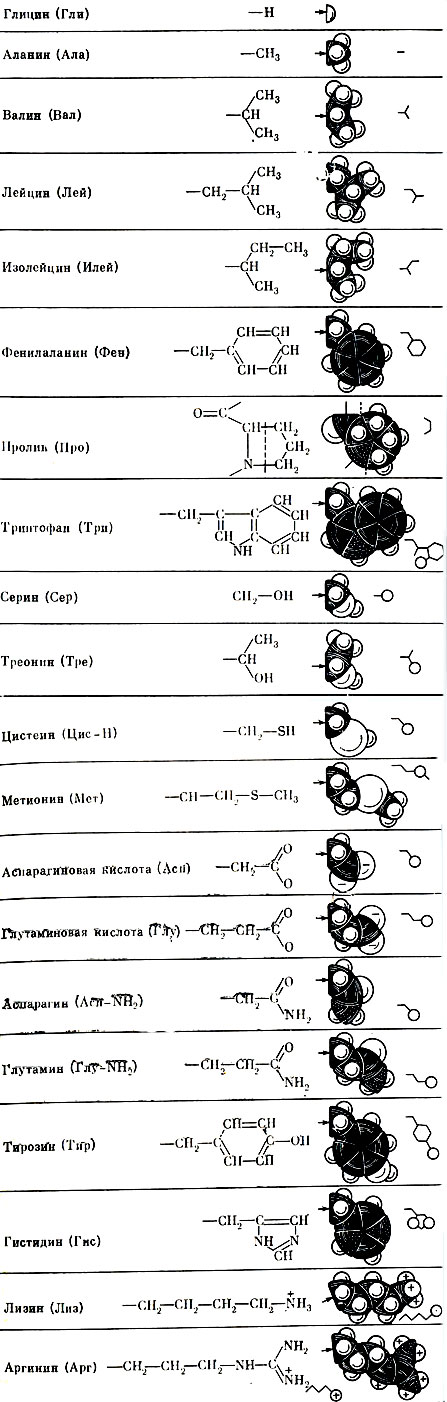
Рис. 8. Боковые цепи (R-группы) 20 наиболее широко распространенных аминокислот
Советские ученые сумели измерить степень упругости молекул некоторых белков. Оказалось, что белки, когда они туго скручены, более упруги, чем каучук. Их можно сравнить скорее с эбонитом. Это обстоятельство имеет особое значение, так как способствует устойчивости расположения различных аминокислотных групп на поверхности молекулы белка.
В настоящее время на структуру белковых молекул ученые стали обращать особое внимание. Прежде всего надо уметь различать эти структуры. То, что мы называем химическим строением полипептидной цепочки (т. е. последовательность расположения аминокислотных остатков), принято называть первичной структурой. Но полипептидная цепочка благодаря взаимодействию ее химических "щупалец" может, извиваясь, как змея, закручиваться в такую спираль*, витки которой как бы связаны особыми (водородными) связями. Так возникает вторичная структура. Эта цепочка тоже может извиваться, свертываться в клубок, складываться тем или иным, иногда самым неожиданным образом. Немалую роль играют одноименные (отталкивающиеся) и разноименные (притягивающиеся) заряды, расположенные на боковых группах мономеров (в данном случае аминокислот). Молекулы с такими зарядами могут также находиться в среде, в которой содержится биополимер, и в какой-то степени способствовать свертыванию цепи. В результате образуется третичная структура, которую ученые обозначают термином "конформация". Но и она может усложняться, самоупаковываться, укладывая отдельные цепи так, чтобы заполнить каждый изгиб тех же цепей (рис. 9). Такому искусству может позавидовать любой квалифицированный упаковщик**.
*(Наряду с альфа-спиралью в белках довольно часто встречается и бета-спираль, в которой изгибы полипептидных цепочек создают сходство со складчатым листком.)
**(В тех случаях, когда объединяются различные по природе макромолекулы, говорят о надмолекулярной структуре.)
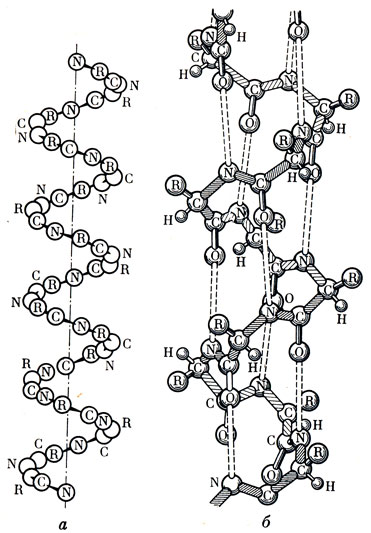
Рис. 9. Схема (а) и модель (б) спиралевидной структуры полипептидной цепи Полинга-Кори
Чему служат такие упаковки, какое значение они имеют для биополимера, хорошо иллюстрирует молекула гемоглобина. Задача этого красящего вещества крови в нашем организме - присоединять, переносить и отдавать кислород. Каждая молекула гемоглобина использует для этой цели свою конформацию: присоединяя кислород, она сжимается, освобождая кислород, - расширяется. Какую бы работу ни выполняли белки клетки, в ней участвуют, переплетая свои действия, первичная, вторичная и другие структуры, чем достигается многообразие и одновременно целеустремленность этой работы. Молекулы с третичной структурой могут приобрести новые качественные особенности, объединяясь в надмолекулярные образования, которые можно назвать их четвертичной структурой. Но особо важна первичная структура. Любое ее изменение влечет за собой соответственное изменение конформации белковой молекулы. Такие изменения пространственного строения очень важны для функции белковой молекулы. Уже известно, что в них играют роль водородные связи, электростатические или ионные взаимодействия (притяжение или отталкивание заряженных группировок), гидрофобные силы (выталкивание молекулами воды боковых цепей аминокислот). Но многое еще подлежит выяснению.
Какую форму имеют молекулы белков? Эксперименты позволили ответить на этот вопрос. Оказалось, что белки состоят из округлых частиц, напоминающих по форме шарик. Шарик - по-латински "глобулус", поэтому подобные белки получили название глобулярных. Белковую глобулу можно представить себе как клубок, смотанный из длинных цепочек. Иногда такая молекула несколько напоминает пирожок или веретено, но их все же называют глобулярными. Отдельные глобулы могут объединяться между собой, создавая таким образом четвертичную структуру белков.
Легко растворимые в воде глобулярные белки играют большую роль в живых организмах. Они содержатся, например, в сыворотке крови. Здесь их форма имеет большое значение. Шарообразным или яйцеобразным молекулам легче проникать сквозь тончайшие капиллярные сосуды кровеносной системы*.
* (Советские ученые С. Е. Бреслер и Д. Л. Талмуд показали, что строение глобулярного белка обусловливается равновесием трех типов сил, действующих в молекуле: 1) легко разрывающихся водородных связей - своеобразных мостиков между группами СО и NH2 (водородные связи создают спиральное строение полипептидов), 2) сил Ван-дер-Ваальса между боковыми углеводородными группами и 3) сил электростатического отталкивания между зарядами на поверхности белковой молекулы. Гидрофобные группы образуют как бы ядро глобулы, а гидрофильные сосредоточиваются на ее поверхности. В некоторых белках существуют еще дисульфидные связи между двумя атомами серы, каждый из которых является как бы отростком остатка аминокислоты цистеина. Такие остатки обычно располагаются далеко друг от друга.)
Наряду с глобулярными широко распространены белки, молекулы которых представляют собой тончайшие нити, волоконца. Эти белки называют волокнистыми - фибриллярными. Мышцы, кожа и многие другие ткани в организме животных и человека построены из таких волокнистых белков. Между глобулярными и волокнистыми белками возможны различные переходы, четкой границы провести нельзя.
Возможность превращения глобулярных белков в волокнистые имеет большое значение для их химических свойств. Некоторые глобулярные, растворимые белки перевариваются в организме. Но если эти белки перевести в нитевидное состояние, они становятся неперевариваемыми.
Другой пример. Поджелудочная железа вырабатывает белковое вещество - инсулин. Он относится к группе гормонов - химических соединений, оказывающих сильнейшее влияние на обмен веществ в организме. Особенно сильно инсулин влияет на содержание сахара в крови, резко его снижая. Инсулин - глобулярный белок, но если его нагреть в присутствии кислоты, он переходит в другую форму и теряет при этом способность влиять на содержание сахара.
Белки, как и другие органические вещества протоплазмы, в живых организмах постоянно распадаются и воссоздаются заново. При этом в каждом органе образуются свойственные ему специфические белки. Как происходит подобный синтез белков? Почему в каждом органе и ткани возникают белки, характерные для соответствующего органа или ткани?
Еще недавно ученые полагали, что в организме распадается только белок, введенный с пищей. Лишь незначительная часть тканевых белков (они составляют почти половину веса человека) подвергается износу. Было даже вычислено, что для человека, весящего 70 кг, количество распадающегося тканевого белка не превышает 23 г в сутки. Эти взгляды, державшиеся в науке десятилетиями, были буквально разгромлены в последнее время благодаря применению метода меченых атомов.
Как известно, радиоактивными можно сделать атомы любых веществ, в том числе и тех кирпичиков-аминокислот, из которых построена молекула белка. Становясь радиоактивными, атомы сохраняют свои первоначальные свойства. В то же время радиоактивный атом можно легко найти среди миллионов других атомов этого же вещества, так как он способен к излучению.
Возможность метить атомы и следить за их передвижением в живом организме позволила ученым увидеть то, что ранее казалось совершенно недоступным. Изучая превращения аминокислот с мечеными атомами, ученым удалось установить, что все тканевые белки постоянно распадаются и синтезируются. Даже белки сухожилий подвержены этому процессу. Такое обновление тканевых белков происходит за счет аминокислот пищевых белков, причем процесс идет с большой скоростью. Установлено, например, что аминокислотный состав белков печени обновляется наполовину в течение нескольких дней. Вопросы самообновления белков - предмет оживленной научной дискуссии.
Итак, вместо разрушающихся тканевых белков организм непрерывно создает новые. Следовательно, он постоянно нуждается в материале, идущем на построение белков. Эта потребность сохраняется на протяжении всей жизни. Откуда же человек получает белки для построения своего тела? Ответ не вызывает сомнения - из пищи, в состав которой входят вещества, содержащие белки.
Подсчитано, что за свою жизнь человек в среднем съедает 2,5 т белка. Такая расточительность (этого количества хватило бы на 200 человек) обусловлена непрерывным обновлением человеческого тела. Но, вероятно, мало кому известно, что существенно не только количество, но и качество белков в пище. Чем больше содержит пищевой белок тех аминокислот, из которых построены белки нашего тела, тем выше биологическая ценность такого белка.
Очень важно и то, что потребности организма человека и животных в различных аминокислотах неодинаковы. Некоторые из этих кислот буквально незаменимы. Они должны быть обязательно введены вместе с пищей, иначе нарушается или совершенно прекращается рост организма, который не способен их синтезировать полностью. Таких незаменимых аминокислот восемь: валин, изолейцин, лейцин, лизин, метионин, треоцин, триптофан, фенилаланин. Есть еще одна очень важная девятая кислота - гистидин, она особенно нужна растущему детскому организму. Некоторые ученые считают, что для детей совершенно незаменима еще одна аминокислота - аргинин.
В настоящее время аминокислотный состав белков различных органов и тканей тела человека и пищевых продуктов изучен достаточно хорошо. Поэтому имеется возможность так комбинировать продукты питания, чтобы человек получал в пищевом рационе все жизненно необходимые аминокислоты в нужных количествах и сочетаниях.
Хорошо известно, что такие пищевые вещества, как жиры и углеводы, могут откладываться в организме про запас, иногда в чрезмерном количестве (у тучных людей). Может ли организм накапливать белки? Опыты на животных дали интересные результаты. Оказалось, что при голодании мозг и сердце "захватывают" белки мыщц, которые становятся для них источником белкового питания. В случае недостатка белков в пище в первую очередь отдают свои белки печень и плазма крови. Можно предположить, что мыщцы, печень, плазма крови содержат резервы белков, которые организм расходует при белковом голодании.
В последние годы ученым удалось расшифровать важное свойство белков - химическую природу их специфичности. В чем выражается специфичность белков? Нагляднее всего она проявилась при переливании крови.
Врачи давно пытались перелить кровь для спасения больных и раненых. Но очень часто больные умирали после переливания. Почему это происходило? Потому, что кровь - это своего рода смесь белков. Белки переливаемой крови отличаются от белка человека, которому переливают кровь: они для него чужие. Переливание крови стало обычным и безопасным делом только после того, как были детально изучены свойства белков крови и найдены средства, предотвращающие специфическое действие чужих белков. Чужими являются не только белки различных организмов - людей, животных, микробов. Даже в одном и том же организме белки различных органов отличаются друг от друга, хотя и имеют много общего.
В специфичности белков известную роль играют различия в форме молекул, расположении в них цепочек и т. д., но главная причина - различия в химическом строении белков, в количестве, повторяемости и особенно в порядке чередования аминокислотных кирпичиков в их молекуле. Но бывает и так, что белки обладают совершенно одинаковыми жизненными свойствами, хотя и отличаются по химическому составу. Поджелудочная железа быка, свиньи, овцы выделяет инсулин. Однако инсулин у этих животных различается и по содержанию аминокислот, и по чередованию их в молекулярной цепочке.
Накоплено довольно много сведений об аминокислотном составе самых разнообразных белков. Как и следовало ожидать, количество аминокислот в них оказалось разным. Некоторые белки состоят всего из нескольких аминокислот. Их с большим правом следует отнести к пептидам. Большинство же белков содержит по нескольку сот аминокислот. Например, фермент рибонуклеаза содержит 124 аминокислоты, а белок крови гемоглобин - 270 аминокислот.
Удалось сделать полный анализ аминокислотного состава белковой молекулы, т. е. произвести ее полную разборку. Но как снова собрать молекулу? Анализ молекулы белка не дал ответа на вопрос, в какой последовательности друг за другом расположены аминокислоты в полипептидной цепи. Не зная этого, нельзя синтезировать белок, так же как нельзя написать слово, не зная, в каком порядке расположены в нем буквы. Ведь в зависимости от порядка чередования аминокислот будут образовываться разные белки, несмотря на их одинаковый аминокислотный состав (рис. 10). Надо было искать последовательность расположения аминокислот в белке. Математики подсчитали, что даже в самой маленькой молекуле белка может существовать 1024 сочетаний аминокислот. Ну, а если взять молекулу белка более крупных размеров, например весом в 120000, тогда число возможных сочетаний достигнет фантастической цифры 101268! Невозможно перепробовать все эти комбинации, чтобы случайно натолкнуться на единственно вероятную. Такой колоссальный труд потребовал бы многих десятков, а может быть, сотен лет.
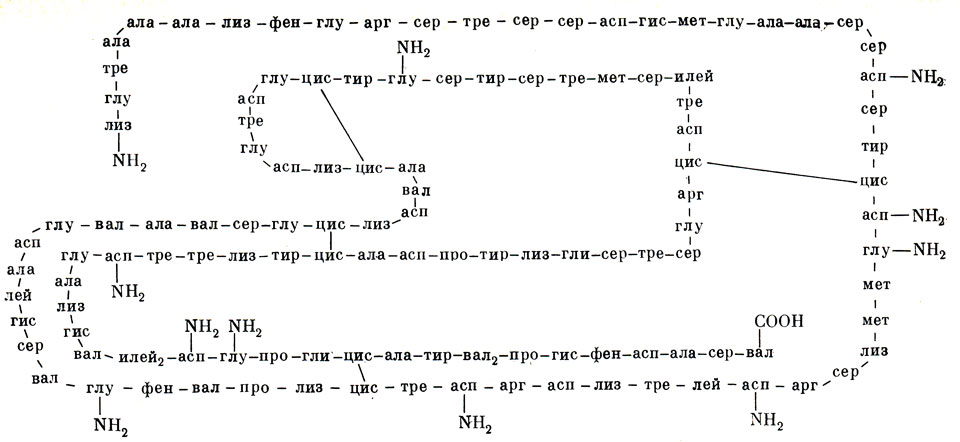
Рис. 10. Схема строения рибонуклеазы
Но ученые нашли выход из создавшегося положения. Оказалось, что для выяснения последовательности расположения аминокислот в белке его нужно "разбирать" не на отдельные аминокислоты, а на более крупные блоки из трех - восьми и более аминокислот и затем по составу этих белков судить о белке в целом. Это легко сделать в случае просто построенных белков с малой молекулой.
В настоящее время несколько белков расшифрованы подобным образом, один из них - белок инсулина. На это английскому биохимику Сэнджеру и его сотрудникам потребовалось 10 лет интенсивной работы. (В наше время на это понадобится всего два-три дня.) Ученые выяснили, что инсулин состоит из двух цепей, из которых одна содержит 21, а другая - 30 остатков аминокислот. Цепи соединены между собой двумя связями - мостиками серы.
Ученым удалось также синтезировать некоторые пептиды. Таким путем американский биохимик Дю-Виньо получил два гормона белковой природы - вазопрессин и окситоцин, выделяемые в организме железой внутренней секреции - гипофизом. Дальнейшим достижением биологической химии можно считать получение искусственным путем одной из цепей инсулина. Это огромный успех, но... для его достижения потребовался напряженный труд десяти ученых в течение трех лет, а живая клетка синтезирует молекулу белка в течение двух-трех секунд!
Чтобы синтезировать целую молекулу инсулина, ученые попытались соединить полученную цепь с другой цепью, выделенной из естественного инсулина. Однако синтезированный продукт оказался малоактивным. Очевидно, тогда не удалось соединить эти две цепи так, как в естественном гормоне. Исследователи продолжают поиски того единственного способа соединения двух цепей инсулина, который дает активный гормон.
Уже разработаны методы синтеза полипептидных цепочек, приближающиеся к тем реакциям, которые существуют в живой клетке. Накопилось большое число фактов, говорящих о том, что большинство белков самой разнообразной природы, многие из которых обладают ферментативной активностью, построены не из одной, а из двух, трех и четырех полипептидных цепей, соединенных друг с другом различными связями. Многие лаборатории мира стремятся выяснить строение таких многоцепочечных белков. Каким путем действует сложное многоцепочечное устройство, почему для ферментативной активности белка в некоторых случаях требуется объединение пептидных цепей вместе? На помощь им приходит могучая техника XX в., дающая в руки ученых ультрацентрифугу, аппаратуру для рентгеноструктурного анализа и специальные пептидные карты.
Но не следует думать, что для проявления биологической активности белков всегда нужна многоцепочечная структура. Во многих случаях белковая молекула, состоящая из одной цепи, биологически активна. Если от одиночной полипептидной цепи фермента рибонуклеазы, состоящей из 124 аминокислот, отщепить несколько десятков аминокислот, то фермент не потеряет своей активности.
Но почему в одних случаях для биологической активности нужна составная многоцепочечная структура, а в других - в этом нет необходимости? Ответив на этот вопрос, вероятно, можно будет ответить и на множество других вопросов, относящихся к секретам биологической активности разных белков, до конца раскрыть тайны белковой молекулы. Это в свою очередь откроет огромные возможности профилактики и лечения болезней, каждая из которых прямо или косвенно связана с нарушением нормального обмена белков в организме человека. В чем заключаются эти возможности? Пример с инсулином - хорошая иллюстрация.
Мы уже говорили о многообразии и видовой специфичности белков. Инсулин животных (для лечения больных диабетом инсулин берут именно у животных) несколько отличается от инсулина человека. А введение чужеродного белка прямо в кровь - дело небезопасное, наш организм может бурно протестовать против этого. Остается один выход - синтезировать точную копию человеческого инсулина и тем самым дать в руки врачам безупречное оружие для борьбы с диабетом.
Белки исключительно разнообразны и по величине молекул, и по молекулярному весу. Трудно представить себе людей, из которых одни весят 50 кг, а вес других доходит до 1000 т. А вот среди белков есть такие, молекулярный вес которых не превышает 2-3 тыс., и наряду с этим встречаются сложные белки - нуклеопротеиды, молекулярный вес которых доходит до 40 млн.! Правда, исследователи все настойчивее утверждают, что нуклеопротеиды не представляют химически индивидуальных соединений. Другими словами, молекула нуклеопротеида неоднородна, она представляет особое сочетание молекул белка и нуклеиновых кислот. Допустим, что это так. Молекулярный вес различных белков колеблется в широких пределах: от нескольких тысяч до миллиона, а молекулярный вес нуклеиновых кислот огромен и часто исчисляется миллионами.
Все живые вещества - от микроскопической бактерии до слона - содержат две нуклеиновые кислоты: рибонуклеиновую и дезоксирибонуклеиновую (рис. 11). Казалось вы, оое эти кислоты должны быть по своим свойствам проще белков. Ведь удивительное разнообразие зависит от различия в сочетаниях тех 20 аминокислот, из которых построена молекула белка, а таких аминокислот в молекуле нуклеиновой кислоты всего четыре. Эти четыре особых химических соединения именуют нуклеотидами. Каждый нуклеотид резко отличается по строению от аминокислот и состоит из азотистого основания, сахара и фосфорной кислоты. Нуклеотиды принято обозначать по первым буквам названий содержащихся в них азотистых оснований: аденина - А, гуанина - Г, цитизина - Ц и тимина - Т. Эти нуклеотиды входят в состав ДНК, а молекула РНК, содержащая также четыре нуклеотида, отличается тем, что вместо тимина - Т содержит урацил - У.
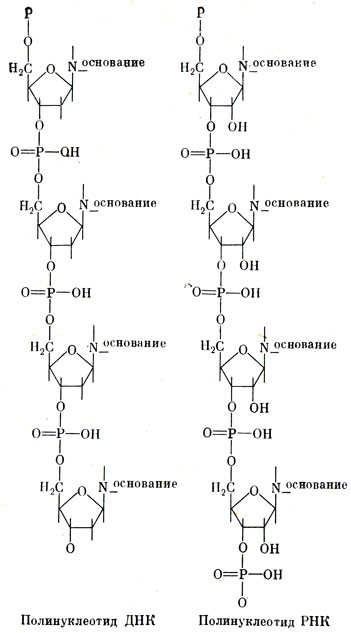
Рис. 11. Схема строения нуклеиновых ('Нуклеус' - по-латыни ядро. В ядре клетки впервые была обнаружена дезоксирибонуклеиновая кислота (дезоксирибоза - название сахара, входящего в ее состав, а рибоза - сахара, входящего в состав РНК).) кислот
Несмотря на кажущуюся простоту строения молекул, нуклеиновые кислоты удивительно разнообразны и отличаются замечательной специфичностью. Невидимые глазу вирусы и бактерии, весь видимый мир растений, животных, наконец, человек - все они содержат свои особые, отличные от иных, нуклеиновые кислоты.
Напишем подряд приведенные выше буквенные обозначения А, Г, Ц, Т и попробуем переставлять буквы. Вот от таких-то вариаций сочетания и зависят отличительные признаки, специфичность одинаковых по весу и химическому составу нуклеиновых кислот, если они построены из одного и того же количества одинаковых нуклеотидов. Но случается и так, что в одних ДНК или РНК будет больше нуклеотидов определенного вида, в других - другого, и такое различие тотчас скажется на биологической активности, по которой нуклеиновые кислоты не уступают носителям жизни - белкам. Они даже в некоторой степени управляют белками, определяют их строение - так можно расшифровать основное свойство ДНК сохранять и передавать наследственные признаки. Самые кардинальные проблемы науки о жизни - биологии - это проблемы сущности процессов наследственности, изменчивости, роста и размножения. Нуклеиновые кислоты, в частности ДНК, занимают здесь ключевые позиции.
Мы еще многого не знаем о нуклеиновых кислотах. Но и того, что известно, достаточно, чтобы поставить их рядом с белками по значению для процесса жизни. Это настоящие биополимеры, строение которых удалось расшифровать лишь недавно.
Ученых долгое время интересовал вопрос - каким образом связаны между собой отдельные нуклеотидные кирпичики в сложной молекуле? Оказалось, что роль соединительных мостиков здесь играют остатки фосфорной кислоты. Выяснилось также, что отдельные нуклеотиды расположены в молекуле каждой нуклеиновой кислоты в строго определенном порядке. Именно эта точная последовательность и определяет качественное отличие одной нуклеиновой кислоты от другой. Природа не была особенно оригинальна в выборе средств для сообщения молекулам "живых" сополимеров отпечатка специфичности. Ведь этот же принцип последовательности чередования аминокислот лежит в основе различий между такими биополимерами, как белки.
Ученым удалось заглянуть еще глубже в строение нуклеиновых кислот. Как показали английские биохимики Дж. Уотсон и Ф. Крик, дезоксирибонуклеиновая кислота представляет собой двойную спираль (рис. 12): две молекулы нуклеиновой кислоты образуют спирали, которые как бы ввинчены одна в другую и в этом виде удерживаются непрочными водородными связями. В таком строении ДНК содержится разгадка важнейшей особенности жизни - передачи наследственных признаков при делении клетки (рис. 13).
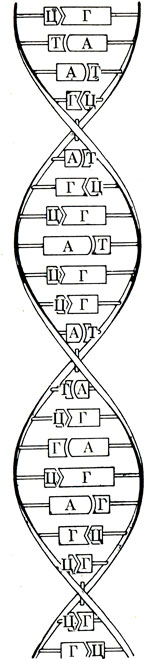
Рис. 12. Двойная спираль ДНК и структурная модель ДНК (по Уотсону и Крику)

Рис. 13. Схема химического строения молекул ДНК из двух полинуклеотидных цепей; основания соединены водородными связями (Н)
Основное назначение митохондрий - накапливать энергию и снабжать ею клетку, микросом (рибосом) - синтезировать белок, а ядра - производить и выделять в цитоплазму различные вещества (например, ферменты), которые регулируют протекающие в ней химические процессы. Наряду с этим и ядро, и митохондрии осуществляют синтез белка и других веществ. Ядро, содержащее ДНК, является "центром управления" клетки. Митохондрии содержат собственную ДНК.
Вернемся к нуклеиновым кислотам. Попытаемся представить себе их участие в передаче наследственных признаков. Для этого они должны обладать способностью к самовоспроизведению - редупликации. Можно думать, что благодаря слабости водородных связей, скрепляющих двойную спираль ДНК, эта спираль легко распадается. Одна из половинок распавшейся спирали - молекула ДНК - играет роль шаблона, матрицы: на ней воссоздается новая молекула ДНК. Вновь возникающая молекула точно повторяет структуру своей матрицы - половинки распавшейся двойной спирали. В результате молекула нуклеиновой кислоты служит для воссоздания себе подобной, происходит ее самовоспроизведение*. Но нуклеиновые кислоты не только самовоспроизводятся, они служат также инструментом, который используется организмом для синтеза белка. Как происходит этот биосинтез?
*(Интересно, что клетка содержит "ремонтную (ферментную) мастерскую" для починки (репарации) повреждений ДНК.)
Мы уже знаем, что отличие одного индивидуального белка от другого определяется прежде всего природой и последовательностью чередования аминокислот, входящих в состав его молекулы. Сведения о порядке аминокислот в белке записаны в ДНК. Передать эти сведения - значит передать наследственность. Совокупность сообщений, которые могут передаваться в процессах управления, получила наименование информации. При передаче информации необходима система, способная передавать сообщение с помощью сигнала определенной природы. Например, когда мы посылаем телеграмму, ее содержание кодируют, т. е. каждую букву выражают азбукой Морзе при помощи точек, тире и пропусков. Можно предположить, что отдельная нуклеиновая кислота передает информацию о строении молекулы белка, "кодируя" синтез совершенно определенного белка точно так же, как ДНК "кодирует" синтез новой молекулы нуклеиновой кислоты. Таким образом, строение нуклеиновой кислоты определяет и строение получающегося белка. В этом и заключается механизм передачи свойств организма по наследству: от родителей к потомкам передается наследственная информация. Для осуществления этого процесса требуются определенные условия. Аминокислоты, необходимые для построения молекулы белка, соединяются друг с другом, если они переходят в деятельное состояние, т. е. активизируются. Источником энергии служат соединения, содержащие фосфор в виде фосфорной кислоты. Активированные аминокислоты переносятся на нуклеиновую кислоту.
Считают, что белок нуклеопротеидов (сложных белков, состоящих из белка и нуклеиновой кислоты) также входит в спиральную структуру ДНК. Таким образом, получается не двойная, а тройная спираль, состоящая из двух молекул нуклеиновой кислоты и одной молекулы белка - полипептидной цепочки. Чередованием звеньев в молекуле нуклеиновой кислоты определяется последовательность звеньев в образующейся полипептидной цепочке белка. После того как нуклеиновая кислота "притянула" к себе определенный набор аминокислот, между соседними аминокислотами образуется пептидная связь, соединяющая их в полипептидную цепочку образованного белка. Этот белок входит в состав нового сложного белка нуклеопротеида. Аналогичным образом происходит и синтез свободных белков. Такие белки, образовавшиеся на молекуле нуклеиновой кислоты, затем отделяются от ее поверхности (рис. 14).
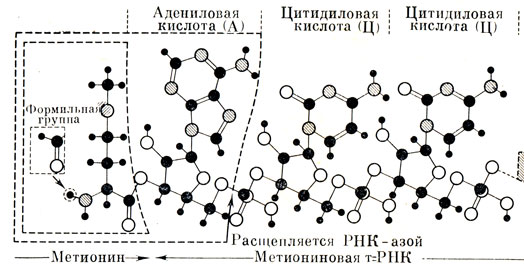
Рис. 14. Перенос аминокислоты к месту белкового синтеза осуществляется молекулами транспортной РНК (т-РНК). Каждой аминокислоте соответствует по крайней мере одна разновидность транспортной РНК. Все транспортные РНК на том конце, который удерживает аминокислоту, имеют последовательность оснований ЦЦА. Здесь же этот концевой участок т-РНК показан связанным с метионином. Существует еще одна т-РНК, которая переносит метионин, причем метионин этот может далее превращаться в формилметионин. При обработке транспортной РНК ферментом рибонуклеазой (РНК-азой) от молекулы т-РНК отщепляется концевое основание (аденин) вместе с прикрепленной к нему аминокислотой. Отщепленный фрагмент носит название аминоациладенозин
Химические процессы, протекающие в клетке, необходимо рассматривать в связи с ее строением. В плазме клетки имеются мельчайшие структурные образования - рибосомы. Именно на рибосомах происходит синтез основной массы белка. Но в состав цитоплазмы входит РНК, а мы знаем, что синтезом белка управляет ДНК, содержащаяся в ядре клетки. Каким же образом генетическая информация, закодированная в ДНК и отображающаяся в последовательности аминокислот в синтезируемом белке, передается к месту синтеза?
Химики установили, что переносчиком генетической информации, или посредником, является особая РНК, которую так и называют "посредник-РНК" (п-РНК)*. Так химия помогла биологам приблизиться к разгадке тайн наследственности. Ведь биологические свойства, специфичность белка характеризуются определенной последовательностью всех составляющих его аминокислот. Соответствующий аминокислотный код передается от ДНК к РНК, которая служит своеобразной матрицей для синтеза определенного белка. Именно специфические белки определяют тип обмена веществ клетки, обусловливая видовые и индивидуальные особенности организма.
*(Позже ее называли информационной РНК (и-PHK), так как она как бы списывает информацию с определенных участков ДНК. и-PHK бактерий "живет" всего несколько минут, и-PHK животных клеток, вероятно, более устойчива. Неполовые (соматические) клетки содержат около 7 триллионов грамма ДНК, половые - вдвое меньше.)
В последние годы химия сделала еще больше - она помогла раскрыть структуру самого кода, показав, что он одинаков для всех живых организмов. Была, наконец, установлена так называемая триплетная (троичная) природа кода, заключающаяся в том, что каждую аминокислоту синтезируемого белка определяют четыре нуклеотида, взятые по три,- триплеты, или кодоны. Стала известна и последовательность нуклеотидов в отдельных триплетах (что, конечно, потребовало огромных усилий мысли и труда). Скоро химики вручат биологам шифр для открытия главного сейфа природы, хранящего секретные планы строения живого белка.
Синтез высокополимерных нуклеиновых кислот осуществлен. Но он протекает на готовой матрице и осуществляется специфическими белками-ферментами. А как же возникли первичные матрицы? Что было раньше: яйцо (белок-фермент) или курица (нуклеиновые кислоты)? И многие ученые пытаются дать ответ на эти вопросы в пользу первичного появления ферментов. Ждала ли природа появления ферментов для синтеза нуклеиновых кислот или они возникли самостоятельно, неферментативным путем? Но а как вообще возникли на Земле первые примитивные нуклеиновые кислоты?
Все эти вопросы представляют большой интерес для науки. Будем надеяться, что окончательный ответ на них дело недалекого будущего.
Наука о биополимерах неуклонно движется вперед, пересматривая сложившиеся представления и развивая новые. Для примера приведем высказывания английского биохимика М. Перутца - одного из крупнейших специалистов по структуре белковой молекулы. Перутц считает, что образование исключительно сложной пространственной структуры белковой глобулы можно уподобить росту кристалла. По-видимому, в различных участках полипептидной цепи имеются группы, образующие зародыш, вокруг которого возникает глобула. Гидрофобные группы* могут играть существенную роль в активности молекулы белка как биологического катализатора.
* (Советские ученые С. Е. Бреслер и Д. Л. Талмуд показали, что строение глобулярного белка обусловливается равновесием трех типов сил, действующих в молекуле: 1) легко разрывающихся водородных связей - своеобразных мостиков между группами СО и NH2 (водородные связи создают спиральное строение полипептидов), 2) сил Ван-дер-Ваальса между боковыми углеводородными группами и 3) сил электростатического отталкивания между зарядами на поверхности белковой молекулы. Гидрофобные группы образуют как бы ядро глобулы, а гидрофильные сосредоточиваются на ее поверхности. В некоторых белках существуют еще дисульфидные связи между двумя атомами серы, каждый из которых является как бы отростком остатка аминокислоты цистеина. Такие остатки обычно располагаются далеко друг от друга.)
Совсем недавно исследования академика А. А. Баева с сотрудниками дали возможность расшифровать строение валиновой (валин - одна из аминокислот) транспортной РНК, что можно считать открытием мирового значения. Можно представить себе формулы только трех звеньев этой РНК - нуклеотидов инозина, аденозина, цитидина*, а всего их в молекуле 81. Точная последовательность нуклеотидов на всем протяжении длинной цепи молекулы установлена А. А. Баевым и его сотрудниками.
*(В составе т-РНК, переносящей аминокислоту аланин, недавно были обнаружены другие нуклеотиды.)
Таким образом, советской наукой сделан еще один важный шаг к познанию живой системы. Но что такое живая система? Можно ли говорить о синтезированном белке или нуклеиновой кислоте, что они "живые", можно ли биополимер называть живым? Пока еще нет. Если синтезированный инсулин обладает свойствами природного инсулина и может быть использован для лечебных целей, то живым его все же назвать нельзя. Ведь молекулы белка и ДНК или РНК - это только составные части живой системы. Попробуем смешать их в пробирке - проявлений жизнедеятельности не наблюдается. Жизнь начинается на более высоком уровне, когда все эти составные части вступают в сложные и, что самое главное, саморегулирующиеся отношения. Советский ученый А. А. Ляпунов определяет живую систему как "высокоустойчивое состояние вещества, использующее для выработки информацию, кодируемую состояниями отдельных молекул". Это очень похоже на то, что мы наблюдаем в клетках, из которых состоит наш организм. И простейшей живой системой, еще не исследованной полностью, остается пока живая клетка. Многие стороны ее жизнедеятельности еще не изучены. Но нет никаких сомнений, что полная разгадка сущности жизни не за горами.
Недавно американскими биохимиками Корнбергом и Туляном синтезирована вирусная частица, т. е. осуществлен синтез "почти живого" вещества. Несколько слов об этом замечательном открытии. Как мы увидим в дальнейшем, в основе как нормальной жизнедеятельности, так и ошибок живой природы всегда лежат самые разнообразные превращения с цепью ДНК. Она разрывается и затем снова воссоединяется своими отдельными участками, или локусами ("локус" - по-латыни участок, место), а такие перестройки иногда чреваты не только полезными, но и вредными последствиями. Цепь иногда теряет спиральную форму и принимает кольчатую (циклическую) форму, найденную в некоторых бактериях. Такая циклическая молекула также может разрываться, но целостность кольца может восстановить особый биологический катализатор, так называемый замыкающий фермент.
Что же сделали в лаборатории Корнберга? Казалось бы, весьма простую вещь. Взяли матрицу - нить ДНК и с помощью замыкающего фермента и другого фермента ДНК - полимеразы - воссоздали из нуклеозидов такую циклическую ДНК, которая проявила вполне жизненные свойства - сумела заразить кишечную палочку. Казалось бы, просто! Но это простота Колумбова яйца. Ведь Корн-берг и его сотрудники впервые в истории науки сумели получить в пробирке то, что еще никому не удавалось до них - полноценную жизнеспособную молекулу ДНК. С тех пор прошло около двух лет, и в Гарвардском университете в США биохимики Боэквит, Айрон и Шапиро выделили чистый ген. Как это удалось сделать? На кишечной палочке могут развиваться пожиратели бактерий - фаги. Это вирусы бактерий. Из них наиболее интересны фаг лямбда и фаг-80. Каждый имеет по одной хромосоме, состоящей из одной ДНК. Эти фаги очень далеки друг от друга. Их хромосомы по своему генному набору резко отличаются. Но в определенных условиях опыта оба фага обладают удивительной способностью - выхватывать из хромосом кишечной палочки только один ген. Применяя биохимические и генетические методы, ученым удалось не только выделить из живой клетки чистый ген, но и накопить большие количества его. Работа гарвардских ученых состояла в том, что они выделили ДНК из упомянутых выше двух видов вирусов. После этого двойные спирали каждого вируса разделили на две нити. Назовем одну из нитей положительной, а другую отрицательной. Ученые воспользовались тем обстоятельством, что положительная нить одного вида ДНК может рекомбинироваться, но только с отрицательной нитью другого вида ДНК. У положительной и отрицательной нитей обоих вирусов оказался общим участок цепи ДНК, состоящий из 6 генов. Эти участки обоих вирусов соединились в двойную спираль, по обоим концам которой оказались непарные цепочки ДНК. Оставалось только удалить с помощью ферментов эти торчащие хвосты, что и было сделано. Таким образом ученые выделили шесть генов, из которых три работают, т. е. управляют синтезом трех специальных белков-ферментов, а остальные три гена как бы следят за работой первых трех, включая или блокируя их по мере надобности.
А весной 1970 г. на конференции в Риге все специалисты слушали доклад индийского ученого Нобелевского лауреата Г. Кхорана о том, как в его лаборатории впервые в истории науки синтезирован ген - основа основ всего живого!
Эти достижения открывают сказочные перспективы. Получена реальная возможность не только получать искусственные белки-ферменты, но и создавать новые катализаторы с заранее заданными свойствами.
Казалось бы, открывающиеся необычайные перспективы должны обрадовать все человечество. Но такова обстановка в капиталистических странах, что первое же известие о замечательном открытии вызвало ряд опасений, что оно будет использовано реакционными силами во вред человечеству. Понадобится настойчивая борьба прогрессивных людей во всем мире, чтобы этого не случилось.
Ну, а теперь мы достаточно вооружены знаниями, чтобы разобраться в основных понятиях науки о наследственности. Вернемся к тем составным частям клеточного ядра, о которых мы еще не упоминали. Но сначала скажем несколько слов еще об одной сенсации в науке о жизни. Речь идет о новой гипотезе, предложенной крупнейшим венгерским биохимиком А. Сент-Дьердьи.
Все мы знаем, что электроны входят в атомы, а атомы образуют молекулы. Некоторые молекулы (акцепторы) всегда готовы захватить чужие электроны, а другие (донаторы) - легко отдают свои собственные. Акцепторы задерживают тканевый рост, но, чтобы они "не перестарались", клетка держит "на цепи" специальный фермент, подавляющий деятельность акцепторов, когда это необходимо. Ну, а если цепь порвется? По мнению Сент-Дьердьи, разорвать ее могут самые разнообразные воздействия: механическое повреждение, действие радиации, вирусная инфекция, различные химические вещества. И тогда освободившийся фермент необратимо подавляет акцепторы и начинается необузданное разрастание ткани - возникновение злокачественной опухоли. Прав ли Сент-Дьердьи - покажет будущее.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'