Задачи и методы патологической физиологии
Занятие 1 (вводное). Значение экспериментального метода в патофизиологических исследованиях
(Ввиду того что настоящее занятие нередко может предшествовать первой лекции, его вводная часть и объяснения некоторых опытов значительно расширены по сравнению с последующими занятиями. Поэтому данное занятие несколько отличается от других по своей структуре и рубрикации.)
Патологическая физиология - основная дисциплина экспериментальной медицины, поэтому в патофизиологических исследованиях экспериментальный метод играет важнейшую роль: он помогает клиницистам в уяснении этиологии, патогенеза и саногенеза различных болезней, а также в разработке научно обоснованных методов терапии (экспериментальная терапия).
Каждый методический прием имеет определенные границы своих возможностей. Если к любой методике предъявляются требования, выходящие за эти границы, она дает неправильный ответ и экспериментатор приходит к ошибочным выводам.
Некоторые методы (например, метод изолированных органов и тканей) носят в основном аналитический характер, в связи с чем они могут правильно отвечать лишь на сравнительно ограниченный круг вопросов.
Более совершенным является метод острого эксперимента, однако и он по самой своей сути имеет ряд серьезных недостатков, связанных прежде всего с наносимой при нем подопытному животному более или менее значительной травмой. Это ограничивает диапазон применения острого эксперимента и постоянно требует соответствующих поправок при оценке его результатов. Значительно более совершенным является хронический эксперимент, приближающий жизнедеятельность подопытного организма к естественным условиям.
Большое значение имеет синтетический метод исследования (например, изучение основного обмена или специфически динамического действия пищи). Однако слишком общие показатели, получаемые при помощи этого метода, не позволяют учесть особенности течения отдельных видов обмена у данного организма, а также проанализировать динамику обменных процессов, развивающихся в это время в различных его тканях и органах.
Наиболее совершенным является аналитико-синтетический метод экспериментального исследования, в основном разработанный и широко примененный для изучения важнейших проблем физиологии и патологии И. П. Павловым и его школой.
Правильно оценивая границы и возможности каждой экспериментальной методики, а также должным образом комбинируя их в определенном сочетании и последовательности, исследователь может добиться большого успеха при выяснении поставленных перед собой задач.
Значение экспериментального метода и диапазон возможностей отдельных экспериментальных методик раскрываются, в частности, на примере изучения этиологии, патогенеза и саногенеза, некоторых форм патологии сердечно-сосудистой системы.
Цель занятия
Показать значение экспериментального метода в изучении патологических процессов. Ознакомить с рядом экспериментальных методик, продемонстрировать некоторые экспериментальные модели болезней, полученные на животных.
Техническое оснащение занятия*
* (Из расчета на группу.)
1. Аппарат для изолированного уха кролика по методу Кравкова - Писемского (см. рис. 1) 1 шт.
2. Аппарат для изолированного сердца 1 шт.
3. Аппарат для измерения бескровным путем артериального давления у собак (на выведенной в кожный лоскут сонной артерии) 2 шт.
4. Ртутный манометр для измерения артериального давления 1 шт.
5. Кимограф с закопченной лентой 1 шт.
6. Электрокардиограф 1 шт.
7. Атравматические иглы 2 шт.
8. Набор инструментов (скальпели, пинцеты, клеммы Диффенбаха, иглодержатели, серфины, рычажок Энгельмана, финдеры, канюли для изолирования уха, изолирования сердца и постановки острого опыта на кролике или кошке с записью артериального давления кровавым путем) 1 комплект
9. Специальные стеклянные канюли для введения в артерию уха 2-3 шт.
10. Рингер-локковский раствор 3 л
11. Раствор адреналина 1:1000 2 мл
12. 25% раствор сернокислой магнезии 200 мл
13. 0,65% раствор хлористого натрия 1 л
14. Раствор сернокислого атропина 2:1000 5 мл
15. Питуитрин Р 3 ампулы по 1 мл
16. Эфир для наркоза 50 мл
17. 5% раствор гексенала 10 мл
18. Пенициллин 300000 ЕД
19. Вата, лигатуры, марлевые тампоны
20. Животные: собаки с предварительно полученной у них нефрогенной и невротической гипертонией и с выведенной в кожную петлю сонной артерией 3 шт.
кролики 4 шт.
лягушки 2 шт.
Наименование опытов и методика их проведения
Задание первое
1. Продемонстрировать методику получения острого инфаркта миокарда путем перевязки левой коронарной артерии.
2. Вызвать "стенокардию" у кролика путем введения токсичной дозы питуитрина.
3. Показать и объяснить сущность экспериментальных моделей нефрогенной и невротической гипертонии (собаки с указанными формами гипертонии готовятся предварительно до занятия со студентами).
Опыт 1. Получение инфаркта миокарда путем перевязки левой коронарной артерии (опыт производится на кролике или собаке).
Операция на кролике. Перед началом операции, которая проводится с соблюдением всех правил асептики, у кролика, привязанного в положении спиной книзу, снимают электрокардиограмму и анализируют ее. Изучают ритм сердечных сокращений (по электрокардиограмме), характер электрокардиограммы, высоту зубцов и длительность интервалов. Затем под гексеналовым наркозом внутривенно вводят сразу 3 мл 5% раствора гексенала, а в течение операции по мере надобности еще 2-3 мл того же раствора (вводить медленно!), послойно вскрывают грудную клетку по третьему межреберью. Ввиду того что у кролика обе плевральные полости разделены друг от друга, односторонний пневмоторакс у них не вызывает тяжелых расстройств и опыт проводится без искусственного дыхания. Рану расширяют, перикард надсекают и с помощью атравматической иглы производят перевязку нисходящей ветви левой коронарной артерии в районе ее отхождения от основного ствола (перевязку можно производить вместе с коронарной веной).
После этого грудную полость послойно зашивают герметизирующим швом; из плевральной полости при помощи шприца отсасывают воздух; в область шва вводят 100000 ЕД пенициллина.
Через час после операции у кролика повторно снимают электрокардиограмму, отмечают смещение сегмента S-Т относительно изоэлектрической линии, появление "коронарного" Т, инверсию Т в грудных отведениях. Делается заключение об электрокардиографических изменениях и о механизмах развития инфаркта миокарда.
Операция на собаке. Перед началом операции у привязанной к станку собаки снимают электрокардиограмму и анализируют ее данные. Операцию проводят так же, как и на кролике, с той лишь разницей, что дается не гексеналовый, а эфирный наркоз, и применяется управляемое дыхание. Перед вскрытием перикарда в его полость вводят 1 мл 1 % раствора новокаина. Через час после операции вновь снимают электрокардиограмму и анализируют ее. Делают выводы о механизмах инфаркта.
Опыт 2. Получение питуитриновой "стенокардии" у кролика. У кролика, привязанного к станку, снимают и анализируют электрокардиограмму, как и в предыдущем опыте. Затем ему внутривенно вводят питуитрин Р из расчета 1 единица на 1 кг веса. Через 3-5 минут с момента введения вновь снимают электрокардиограмму. Отмечается резкая брадикардия, смещение сегмента S-Т относительно изоэлектрической линии, появление "коронарного" Т, удлинение интервала Р-Q. Делают заключение относительно механизмов развития коронароспазма и наблюдаемых изменений электрокардиограммы.
Опыт 3. Экспериментальная модель почечной гипертонии у собаки. Животному с предварительно выведенной в кожный лоскут общей сонной артерией. После удаления шерсти на спине в области почек и тщательной обработки операционного поля в стерильных условиях производят соответствующие разрезы кожных покровов и подлежащих мягких тканей, через которые выводятся почки. Поочередно на обе почки накладывают капсулы из стерильной целлофановой пленки (во избежание некроза почки капсулы не должны сильно сжимать почечную ткань).
После наложения капсулы почки возвращают на обычное место; мягкие ткани и кожные покровы послойно зашивают. Операцию проводят под эфирным наркозом или местной анестезией. Гипертонические явления у экспериментального животного развиваются обычно на 4-5-й день после операции.
Опыт 4 (демонстрация). Экспериментальная модель невротической гипертонии у собаки. Демонстрируется собака, у которой был вызван экспериментальный невроз перенапряжением подвижности возбудительного и тормозного процессов (или каким-либо другим путем). У животного на фоне нарушенной высшей нервной деятельности отмечаются выраженные вегетативные расстройства, в числе которых возникает и более или менее стойкое повышение артериального давления.
Длительное нарушение кровоснабжения (ишемия) почек или функциональный невроз могут привести к развитию стойкой гипертензии. Данные модели представляют значительную ценность для понимания этиологии и патогенеза гипертонической болезни у человека.
Задание второе
1. Показать, что всякий экспериментальный метод имеет определенные границы.
2. Познакомить студентов с логическим развертыванием научного мышления экспериментатора, а также мотивами выбора, комплектованием и последовательностью включения методических приемов, используемых для решения поставленной научной задачи.
Опыт 1. Изменение артериального давления под влиянием внутривенного введения адреналина (острый опыт). У кролика (или кошки) весом в 2-2,5 кг под легким эфирным наркозом отпрепаровывают и берут на лигатуры сонную артерию, яремную вену и оба ствола блуждающего нерва на шее.
В сонную артерию вводят канюлю и через ртутный манометр записывают артериальное давление на закопченной ленте кимографа.
После записи нормального артериального давления, а также ритма и амплитуды сердечных сокращений животному вводят в яремную вену 1 мл свежеприготовленного раствора адреналина в концентрации 1:40000.
Наблюдается резкое повышение артериального давления и на подъеме ярко выраженный вагусовый эффект (вагус-пульс). Затем артериальное давление падает ниже нормы и вскоре выравнивается до первоначального уровня (двухфазное действие адреналина). Полностью восстанавливаются также ритм и амплитуда сердечных сокращений.
Вывод. Адреналин, введенный внутривенно в дозе 1 мл в разведении 1:40000, вызывает у экспериментального животного резкое повышение артериального давления с ярко выраженным вагус-пульсом и последующее кратковременное падение давления крови ниже первоначального уровня.
Опыт 2. Изменение тонуса сосудов изолированного уха кролика под влиянием адреналина (рис. 1). Сначала устанавливают устойчивое количество капель рингер-локковской жидкости, протекающей через сосуды изолированного уха кролика за минуту. Затем через сосуды уха пропускают свежеприготовленный раствор адреналина на рингер-локковской жидкости в разведении 1:50000000.
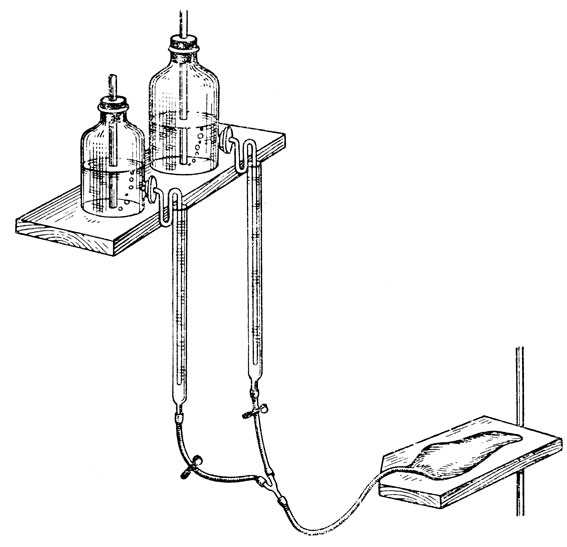
Рис. 1. Схема установки для перфузии изолированного уха кролика по Кравкову - Писемскому
Наблюдается сокращение сосудов, выражающееся в уменьшении количества вытекающих из сосудов уха капель на 30-50% по сравнению с исходным. Снова пропускают через сосуды изолированного уха чистую рингер-локковскую жидкость. Пропускная способность сосудов, т. е. их просвет, постепенно восстанавливается до первоначального уровня.
Вывод. Адреналин вызывает сокращение периферических сосудов.
Опыт 3. Изменение деятельности изолированного сердца под влиянием адреналина. Работа изолированного сердца теплокровного или холоднокровного животного записывается через серфинную передачу и рычажок Энгельмана на закопченной ленте кимографа.
Записав исходный ритм и амплитуду сердечных сокращений, пропускают через изолированное сердце свежеприготовленный раствор адреналина на рингер-локковской жидкости (а для сердца лягушки - на 0,65% растворе хлористого натрия) в разведении 1:500000 - 1:1000000.
Устанавливают резкое увеличение амплитуды и учащение ритма сердечных сокращений (рис. 2). Снова переключают изолированное сердце на чистую рингер-локковскую жидкость. Ритм и амплитуда сердечных сокращений приходят к исходному уровню.
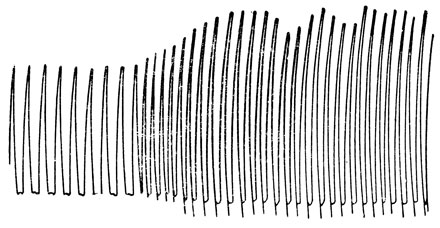
Рис. 2. Влияние адреналина на изолированное сердце лягушки
Вывод. Адреналин вызывает резкое увеличение амплитуды и учащение ритма сердечных сокращений.
Учитывая результаты опытов 2 и 3, можно прийти к заключению, что адреналин в примененных концентрациях вызывает повышение артериального давления (опыт 1) у животного за счет сокращения периферических сосудов и усиления деятельности сердца.
Однако опыты на изолированных сосудах и сердце не позволяют сделать сколько-нибудь полного вывода о всех сторонах действия адреналина на организм. Более того, некоторые данные, полученные в опытах с действием адреналина на изолированные органы, противоречат данным, полученным в опыте на цельном животном. Так, адреналин, введенный в кровеносное русло кролика или кошки, вызывает у них, кроме повышения артериального давления также и явление вагус-пульса. В противоположность этому на изолированном сердце под влиянием адреналина возникает не урежение сердечного ритма, а, наоборот, резкое его учащение. Ясно, что это противоречие объясняется более сложными механизмами реализации действия адреналина в цельном организме животного, чем это бывает при воздействии адреналина на изолированные органы.
Важнейшую роль в механизме действия адреналина выполняет нервная, в частности вегетативная, нервная система. Данные опыта 1 показывают активное участие в реализации действия адреналина на животный организм парасимпатического отдела (наличие вагус-пульса).
Для выяснения роли вагуса в действии адреналина на артериальное давление проводят следующий дополнительный опыт.
Опыт 4. Действие адреналина на артериальное давление предварительно атропинизированного (или ваготомированного) кролика. Тому же экспериментальному животному, на котором проводился опыт 1, с целью выключения периферических окончаний вагуса через яремную вену вводят 1,5 мл сернокислого атропина в разведении 2:1000. Через 15 минут после введения атропина в яремную вену животного вводят прежнюю дозу адреналина (1 мл адреналина в разведении 1:40000).
Наблюдается резкое повышение артериального давления, однако вагус-пульс отсутствует (рис. 3).

Рис. 3. Влияние адреналина на кровяное давление нормального (верхняя кривая) и атропинизированного (нижняя кривая) кролика
Если периферические окончания вагуса выключены полностью, то отсутствует и вторая фаза действия адреналина, которая, как было указано выше, проявляется кратковременным падением артериального давления ниже нормы.
Такой же эффект, как и в опыте 4, можно получить не только введением сернокислого атропина в кровь экспериментальному животному, но и пересечением ему обоих шейных стволов вагуса.
Вывод. Явление вагус-пульса и вторая фаза адреналинового эффекта связаны с активным участием парасимпатического отдела вегетативной нервной системы в механизме воздействия адреналина на организм животного. Эта особенность действия адреналина не выявляется методом изолированных органов.
На данном примере раскрываются и возможности, и ограниченность соответствующих экспериментальных методов, используемых для выяснения стоящей перед исследователем задачи.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'