Гормоны
Великолепной восьмеркой можно назвать железы внутренней секреции - специальные органы нашего тела, вырабатывающие замечательные химические вещества - гормоны. Эти вещества выделяются в кровь и доставляются в различные органы и ткани, которыми они безраздельно распоряжаются. При этом гормоны воздействуют и на нервные окончания органов. В свою очередь центральная нервная система (кора головного мозга) держит под контролем железы внутренней секреции, направляя в них импульсы, усиливающие или ослабляющие их деятельность.
Таким образом, железы внутренней секреции тесно связаны с центральной нервной системой в деле регуляции химических процессов обмена веществ в нашем теле, но каждая железа работает самостоятельно.
Щитовидная железа вырабатывает гормоны, содержащие йодтироксин и трийодтиронин. Необходимый для этого йод поступает из крови (он входит в молекулу аминокислоты тирозина). Тироксин, образование которого в значительной мере находится под контролем особого тиреотропного гормона, образующегося в гипофизе, давно уже синтезирован. Такой тироксин в случае надобности можно вводить в организм. Но еще проще при нехватке тироксина давать небольшие количества йода, и организм сам будет вырабатывать нужное ему количество тироксина.
Как действуют гормоны щитовидной железы на химизм организма человека? Они регулируют интенсивность дыхания клеток. Избыток этих гормонов как бы подстегивает общий обмен веществ, уровень которого может повыситься почти вдвое. Но работоспособность, которая должна была бы при этом повыситься, значительно снижается. Это объясняется тем, что при усиленном выделении гормонов - гиперфункции - повышается обмен белков, мышцы теряют очень важное для них азотистое вещество - креатин. Может даже возникнуть отрицательный азотистый баланс. Организм обедняется и жирами. На обмене углеводов гиперфункция сказывается в обеднении печени гликогеном. Обмен веществ в костях повышается, вследствие чего резко увеличивается выделение организмом кальция и фосфатов (солей фосфорной кислоты). И, наконец, гиперфункция щитовидной железы повышает активность многих ферментов, "работающих" внутри клеток.
Гипофункция - недостаточное производство гормонов щитовидной железы, вызываемое недостатком йода или повреждением железы,- сопровождается явлениями обратного порядка: замедляется обмен веществ, останавливается рост тела, что вызывает карликовость и кретинизм (отставание психического развития).
Рассмотрим деятельность другой железы внутренней секреции - надпочечников. В этих железах необходимо различать два четко разграниченных отдела, работающих по-разному: мозговое вещество и кору. Гормоны мозгового вещества - адреналин и норадреналин* - очень близки друг другу по химическому строению и по действию на кровообращение. Они суживают сосуды, но в тканях (особенно в мышцах) адреналин расширяет сосуды, повышает частоту сердцебиения. Сходство на этом кончается. Норадреналин не влияет на химизм организма, тогда как адреналин повышает обмен веществ, усиливает мышечную работоспособность и расщепление гликогена в печени и в мышцах, вследствие чего увеличивается содержание сахара в крови**.
*(Их называют также нейрогормонами. Эти гормоны соединяются с АТФ - аденозинтрифосфорной кислотой - и отлагаются в окончаниях нервных волокон.)
**(Адреналин не только повышает содержание сахара в крови (гипергликемия), но может обусловить и переход сахара в мочу (глюкозурия).)
Действие адреналина объясняется тем, что он активирует в печени и мышцах фосфорилазу, которая ускоряет распад гликогена. Адреналин и продукты его превращения по своей химической природе относятся к симпатинам - химическим передатчикам (медиаторам) импульсов от симпатических нервов к органам.
Адреналин - очень нестойкое, легко окисляющееся вещество. Но у него имеется в нашем теле верный друг - аскорбиновая кислота (витамин С), которая не только содействует строительству молекулы адреналина из аминокислоты (тирозина), но и предохраняет ее от влияния окисляющих веществ.
Следует ли считать адреналин незаменимым для организма человека гормоном? Теоретически можно обойтись без него, так как его роль сумела бы непосредственно взять на себя нервная система. Но опыты на животных, у которых удаляли мозговую часть надпочечников, вырабатывающую адреналин, не доказывают, что они могут жить без адреналина, так как в организме имеются добавочные тельца такого же строения, вырабатывающие этот гормон*. Да и может ли организм обходиться без адреналина, который регулирует работу многих органов? Впрочем, основное значение этого гормона заключается в усилении работы мышц. Как это происходит?
*(Как адреналин, так и норадреналин можно получать синтетическим путем.)
Мы уже говорили о том, что адреналин усиливает расщепление гликогена в печени, которая наводняет кровь образующимся при этом виноградным сахаром - глюкозой. Кровь разносит глюкозу по тканям. Одновременно в мышцах усиливается распад гликогена с образованием молочной кислоты, другими словами, происходит то, что наблюдается в работающей мышце. Имеются все основания полагать, что из молочной кислоты снова образуется глюкоза, а это связано с усилением окислительных процессов. В результате возрастают потребление кислорода и образование тепла. Повышая кровяное давление, усиливая деятельность сердца, снижая утомляемость мышц, углубляя дыхание, адреналин как бы приводит весь наш организм в состояние боевой готовности. В свою очередь мышечная работа, сильные волнения увеличивают поток нервных импульсов к железе и повышают выделение ею адреналина. Отметим здесь же, что адреналин повышает содержание сахара крови, только пока в печени имеется соответствующее количество расщепляемого под его влиянием гликогена. Поэтому при сахарной болезни адреналин не играет существенной роли в нарушении обмена веществ.
Итак, адреналин отличается сахароповышающим действием, а инсулин - сахаропонижающим. Отсюда, казалось бы, один шаг до вывода, что оба гормона - непримиримые враги, всегда действующие наперекор друг другу, и что сахарная болезнь - результат "схватки", в которой адреналин берет верх над инсулином. В действительности это не так. Конечно, некоторый антагонизм между адреналином и инсулином существует. Но оба гормона могут содействовать общей цели - усиливать использование глюкозы в организме. Такое содружество принято называть синергизмом.
Выше мы упоминали, что корковая часть надпочечников очень важна для организма: удаление ее неизменно сопровождается гибелью животного. Кора (по-латыни "кортекс") вырабатывает десятки гормонов. Но так как большая часть этих гормонов химически неустойчива (они легко превращаются друг в друга), то, вероятно, многие из них не являются истинными кортикоидными (корковыми) гормонами. Настоящих гормонов всего пять, и их можно разделить на две группы: минералокортикоиды и глюкокортикоиды. Первые - дезоксикортикостероп и особенно альдостерон - играют роль ОРУДа водно-солевого обмена. Они обладают способностью задерживать в нашем теле (в крови, тканевой лимфе) воду и натрий и снижать содержание калия. В результате через почки и мочу уходит много калия и очень мало натрия. Все органы нашего тела чувствительны к сдвигам, которые изменяют их деятельность. При этом изменяется проницаемость клеток: калий проникает в них легко, а проникновение натрия внутрь клетки замедляется. Это главная черта действия минералокортикостороидов. Но они влияют не только на минеральный обмен. Под их воздействием в печени и почках усиливается отщепление азота от аминокислот (дезаминирование), в связи с чем моча выделяет больше азота. Увеличивается и общий обмен белков. Но на обмен белков в гораздо большей степени влияют глюкокортикоиды: кортизол, кортизон и кортикостерон. Эти гормоны усиливают распад белков и аминокислот и, следовательно, выделение азота из организма.
Следовательно, несмотря на свое название, глюкокортикоиды вмешиваются в обмен белков (и липидов). Все же название оправдано, потому что в результате вмешательства происходит образование глюкозы, которую глюкокортикоиды "защищают" от окисления. А мышцы отдают свой гликоген печени, которая усиливает его накопление. В общем действие глюкокортикоидов в организме напоминает то, что происходит в нем при сахарной болезни - диабете.
И все же разница между минерало- и глюкокортикоидами не очень отчетлива, так как первые могут влиять и на обмен углеводов, а вторые воздействуют и на водно-солевой обмен нашего организма.
Современная медицина сумела использовать замечательное свойство глюкокортикоидов подавлять процессы воспаления и так называемую аллергию. Эти процессы характерны для таких тяжелых заболеваний, как острый ревматизм и бронхиальная астма. В таких случаях препараты глюкокортикоидов могут действовать как замечательные лекарства. Недостатком подобных лекарств могут быть нежелательные явления со стороны минерального обмена, что требует большой осторожности при их использовании.
Таковы основные черты химизма действия кортикоидных гормонов. Недостаток их вызывает явления обратного порядка. Поэтому организм строго следит за работой коры надпочечников и регулирует ее действием специального адренокортикотропного (т. е. действующего на кору надпочечников) гормона, сокращенно АКТГ, который вырабатывается другой железой - гипофизом.
Родоначальником кортикоидных (и половых) гормонов является холестерин, поэтому их называют также стероидными гормонами. Следовательно, кортикоиды и половые гормоны - близкие родственники, и не удивительно, что половые гормоны могут вырабатываться (правда, в небольшом количестве) и в коре надпочечников.
Кортикоидные гормоны, выполнившие свою работу, начипают разрушаться печенью, и продукты распада выводятся в основном с мочой. Некоторые гормоны, не подвергаясь распаду, выделяются в виде соединений с глюкуроновой кислотой (иногда и серной). Определяя количество выделяющихся стероидных гормонов, врачи могут получить представление о работе коры надпочечников.
В тех случаях, когда кора надпочечников начинает "шалить", наблюдается гиперфункция или гипофункция деятельности этой железы, что вызывает различные заболевания. Повышенная выработка альдостерона ведет к гипертонии, снижению содержания калия и повышению уровня натрия в плазме крови. Иногда кора вместо кортизола усиливает выработку полового мужского гормона андрогена, что у женщин может привести к маскулинизации - мужеподобности. Недостаток деятельности коры надпочечников может вызвать тяжелое заболевание - аддисонову болезнь.
Очень важную роль в деятельности нашего организма играет поджелудочная железа, вырабатывающая инсулин - белковый гормон, управляющий в основном углеводным обменом. Инсулин (по-латыни "инсула" - остров) образуется в особых островках клеток в поджелудочной железе. Большая часть железы участвует в процессе пищеварения. В этом случае она ведет себя как железа внешней секреции, но вторая ее профессия - выделение гормона инсулина, т. е. проявление внутренней секреции.
Как действует инсулин? Это единственный гормон, вызывающий понижение содержания сахара в крови, вмешиваясь в работу печени и мышц. Инсулин задерживает два противоположных процесса: распад гликогена и новообразование этого сложного углевода. Таким образом в печени сохраняется определенный уровень гликогена, отдача глюкозы в кровь тормозится. А в мышцах инсулин усиливает использование глюкозы, способствуя ее окислению и образованию гликогена.
Но этим действие инсулина не ограничивается. Он как бы подавляет стремление аминокислот уклониться от участия в строительстве молекулы белка и превратиться в глюкозу и побуждает их участвовать в синтезе белка. Инсулин влияет и на обмен жирных кислот: задерживает распад и повышает синтез. Бурная деятельность инсулина проявляется и в том, что он может, например, понизить уровень сахара в крови ниже допустимых пределов. Такое состояние (гипогликемия) опасно в первую очередь для мозга. В этом случае островки поджелудочной железы выпускают другой гормон - глюкагон, который повышает уровень сахара в крови, напоминая этим действие адреналина. Как инсулин, так и глюкагон уже получены синтетическим путем.
Совершенно иной характер носит деятельность других желез. Две пары крохотных телец, расположенных у задней поверхности щитовидной железы, называемые поэтому паращитовидными железами, заняты производством мощного паратгормона, представляющего собой белковоподобное соединение. Этот гормон регулирует обмен кальция и фосфора, усиливая работу особых клеток (остеобластов), разрушающих костную ткань. При этом освобождается кальций, который переходит в кровь и в большом количестве выделяется с мочой.
Когда деятельность паращитовидных желез отклоняется от нормы, они вырабатывают недостаточное или избыточное количество гормона. В обоих случаях организм испытывает неблагоприятное воздействие. Избыток гормона удаляет кальций и фосфор из организма. В результате в крови содержание кальция увеличивается, а фосфора, наоборот, уменьшается. Происходит усиленное разрушение костной ткани, кости легко искривляются. При недостатке гормона содержание кальция в крови уменьшается, а фосфора увеличивается; выделение их с мочой снижается. Нарушается работа главной химической лаборатории нашего тела - печени. Усиливается возбудимость нервов и мышц, могут появиться внезапные припадки судорог. Чаще это наблюдается у беременных женщин и детей.
Половые железы - семенники (мужские) и яичники (женские) - играют важнейшую роль в процессах, связанных с размножением. Гормоны семенников называют андрогенами (греческое "андрос" - мужчина, "генос" - род). Самый важный из них - тестостерон. Эти гормоны способствуют развитию половых органов мужчины и его вторичных половых признаков. Яичники вырабатывают гормоны - эстрогены (греческое "эстрос" - страсть, "генос" - род), среди которых особо важную роль играют эстрадиол и близкий к нему эстрон (фолликулин).
Половые гормоны - малоустойчивые соединения, которые легко превращаются в менее активные или совсем неактивные вещества (главным образом в печени). Надо полагать, что и мужские и женские половые железы обладают способностью вырабатывать оба гормона, и мужской, и женский. Разница лишь в количественных соотношениях. Этой же способностью обладают и надпочечные железы.
Все половые гормоны - химические родственники холестерина. Интересно отметить, что искусственным путем получены вещества, химически далекие от холестерина, но проявляющие эстрогенную активность. К сожалению, биохимический механизм действия половых гормонов пока еще далек от выяснения. Можно только с уверенностью сказать, что они влияют (повышая ее) на активность ряда ферментов, в первую очередь ферментов, участвующих в клеточном дыхании.
Еще менее изучены гормоны двух желез: зобной и шишковидной. Обычно зобная железа функционирует только в детском возрасте, но известны случаи, когда она увеличивается у взрослого человека, что является причиной тяжелой, все нарастающей мышечной слабости. Гормон шишковидной железы вообще неизвестен.
Теперь мы остановимся на одной небольшой железе, которая вырабатывает гормоны, регулирующие деятельность не только органов нашего тела, но и их регуляторов - других желез внутренней секреции. Это мозговой придаток - гипофиз, в котором различают переднюю долю - аденогинофиз и заднюю долю - нейрогипофиз, а также промежуточную область.
Аденогипофиз занимает особое место. Это универсальный орган внутренней секреции, действующий на обмен углеводов, жиров, белков, рост организма и на многие другие железы внутренней секреции. Он вырабатывает несколько гормонов, которые способствуют ускорению роста - гормон роста, выделению молока - пролактин, действует на щитовидную железу - тиреотропный гормон, стимулирует кору надпочечников - адренокортикотропный гормон, или АКТГ, на половые железы - гонадотропные гормоны.
Аденогипофиз вырабатывает и меланофорный гормон, который влияет на красящее вещество - меланин, содержащийся, например, в сетчатке глаза.
Расстройство деятельности аденогипофиза может привести к чрезмерному похуданию или, наоборот, к ожирению. Недостаток деятельности железы по выработке гормона роста может сделать детей карликами, повышенная работа железы приводит к гигантизму, а у взрослых людей - к акромегалии - ненормальному росту конечностей, челюсти, языка и других органов. В чем заключается вмешательство гормонов гипофиза в химизм нашего тела?
Гормон роста влияет на обмен белков, стимулирует их синтез, в первую очередь в мышцах, меньше в печени. Как следствие этого с мочой выделяется меньше азота (ведь азотистые вещества - аминокислоты - расходуются на строительство молекул белков) и уровень аминокислот в плазме крови также снижается. В этом отношении гормон роста противодействует упоминавшемуся выше адренокортикотропному гормону, который повышает распад белков. Гормон роста как бы заботится об экономии расходования белков, поставляя вместо них жиры, распад которых при этом повышается, а печень захватывает жиры и образует кетоновые тела. Гормон роста действует также в противовес инсулину и как бы подталкивает организм к сахарной болезни, так как снижает использование глюкозы и повышает ее уровень в крови. Наконец, гормон роста способствует развитию воспалительных процессов, тогда как адренокортикотропный гормон их угнетает.
Тиреотропный гормон воздействует на щитовидную железу, в которой активирует деятельность ферментов - нротеаз, высвобождающих гормон этой железы - тироксин. Одновременно наблюдается обратная связь между уровнем тироксина в крови и выделением тиреотропного гормона в кровяное русло (адреналин тоже повышает выделение этого гормона). В плазме крови тиреотропный гормон путешествует не один, с ним тесно связан белок - бета-глобулин.
Адренокортикотропный гормон, или АКТГ, - вещество белковой природы, точнее, полипептид, состоящий почти из сорока аминокислот. Химикам уже удалось синтезировать вещество, похожее на АКТГ. Гипофиз иод влиянием различных воздействий (нервной системы, специального гормона промежуточного мозга, адреналина) способен сразу выбрасывать большие количества АКТГ, которые тотчас снижают в надпочечниках содержание холестерина и аскорбиновой кислоты, способствуют образованию кортикоидных гормонов, освобождению и переходу их в кровь. Но кортикоидные гормоны, наоборот, тормозят освобождение АКТГ из гипофиза. Меланофорный гормон очень похож по составу на АКТГ, но отличается от него тем, что действует только на образование красящего вещества (пигментацию) в сетчатке глаза, возможно, и кожи (например, потемнение ее при беременности).
Задняя доля гипофиза вырабатывает два гормона: окситоцин и вазопрессин. Они оказались в близком химическом родстве (пептиды, состоящие из девяти аминокислот), и оба уже синтезированы химиками. Действуют эти гормоны в одной области, способствуя сокращению беременной матки, выделению молока, снижению образования мочи, повышению кровяного давления. Только первыми двумя процессами занимается больше окситоцин, а последним двум отдает предпочтение вазопрессин. Можно с уверенностью сказать, что вазопрессин способствует проникновению воды через оболочки клетки.
Средняя область гипофиза образует гормон меланотропин, или интермедии. Результаты его деятельности пока еще не выяснены полностью. Можно предположить, что он влияет на передачу нервного возбуждения, а также на пигментацию кожи.
Различные периоды жизни нашего организма характеризуются определенными комбинациями действий различных гормонов. Таким образом, можно всегда обнаружить характерные черты в деятельности желез внутренней секреции в детстве, в период половой зрелости, старости, менструаций и беременности. Так, например, при беременности яичники вырабатывают гормон релаксин (белковое вещество), который, разрыхляя соединительную ткань, облегчает раздвигание костей таза во время родов. Похожие на гормоны вещества (гормоноиды) образуются и в других органах нашего тела. Некоторые из них уже хорошо изучены. Так, например, образующийся в слизистой оболочке кишок секретин, попадая в кровь, возбуждает выделение воды и бикарбоната в соке поджелудочной железы. Другой гормон - гастрин - образуется в слизистой оболочке желудка. Он вызывает выделение желудочного сока, главным образом соляной кислоты.
Кроме адреналина и норадреналина в ходе биохимических превращений в организме возникают амины, которые, не являясь гормонами, отличаются высокой биологической активностью. Таких биогенных аминов известно несколько десятков. Из них особого внимания заслуживают серотонин, дофамин, гистамин.
Как известно, молекула белка состоит из многочисленных остатков аминокислот. Одна из таких аминокислот - гистидин, который под действием фермента декарбоксилазы (отщепляющего кислотную группу - карбоксил) образует гистамин. В здоровом организме гистамин неактивен. Он как зверь на цепи, притаившись, ждет освобождения, которое наступает при ряде заболеваний. Вырвавшийся на волю, гистамин может наделать немало бед: вызвать крапивницу, сывороточную болезнь, сенную лихорадку и др. Из аминокислоты диоксифенилаланина образуется дофамин, который в противоположность гистамину действует благоприятно при некоторых заболеваниях нервной системы. Серотонин играет важную роль в регуляции функций мозга и сердечно-сосудистой системы.
Интересно, что биогенные амины могут как-то откладываться про запас в организме. Известно немало средств, позволяющих использовать эти резервные фонды аминов. Но в природе биогенных аминов многое еще подлежит изучению.
В заключение можно сказать, что эндокринные железы - мощный регулятор процессов, протекающих в организме, контролируемых нервной системой. Как осуществляется этот контроль? Очевидно, путем воздействия на определенные ферменты, например контролирующие пропускную способность клеточных оболочек. Можно представить себе гормон в роли своеобразной кнопки, при "нажатии" которой изменяется деятельность определенной ферментной системы. Некоторые гормоны выступают в роли активаторов и ингибиторов ферментов, участвуют в биосинтезе белка. Вообще механизм действия гормонов и их роль в нашем организме - одна из важнейших проблем современной биологии.
А теперь перейдем к ошибкам гормонов.
Кроме упомянутых выше "классических" гормонов за последнее десятилетие интенсивно изучаются различные полипептиды, которые получили название "местных" гормонов - кининов. Почему же именно местных? А потому, что их не вырабатывают железы внутренней секреции. Кинины - своеобразные невидимки, открывающие свое лицо только по зову организма и только там, где организму нужно: в некоторых тканях (вернее, в их межтканевой жидкости), в центральной нервной системе, в плазме крови. Свое, порой очень сильное действие они там же и оказывают, потому что в общем кровотоке их сразу же разрушают специальные ферменты. Но почему мы назвали кинины невидимками? Дело в том, что они сущеетвуют, но ничем не проявляют своего действия. Из таких предшественников кинины освобождаются особыми ферментами - калликреинами.
Итак, рождение и гибель кининов зависит от действия ферментов. Все обстоит хорошо, если скорость образования или распада кининов не выходит за пределы нормы. Но, если произошла ошибка (а мы уже знаем, что такие ошибки могут происходить) и возникли уродливые молекулы ферментов или нужные ферменты вообще не образовались? Тогда возникает наследственная болезнь. Впрочем, болезнь может быть и ненаследственной, так как на скорость образования или распада кининов могут действовать и другие обстоятельства, например воспаление.
В чем же проявляется действие кининов? Они обладают способностью расширять просвет сосудов и увеличивать скорость кровотока, снижать кровяное давление, повышать проницаемость капилляров и... вызывать чувство боли.
Более подробно мы остановимся только на кининах плазмы крови: брадикинине и его ближайшем родственнике - каллидине. Интересно, что ученые сумели синтезировать брадикинин прежде, чем было установлено его точное строение! Брадикинин и каллидин образуются под действием особых ферментов - калликреинов (иногда и некоторых других ферментов) из своих неактивных предшественников - брадикининогена и каллидиногена, которые содержатся в особых белках плазмы крови - в альфаг-глобулинах. Образование и распад брадикинина и каллидина в организме - чрезвычайно сложный, пока еще полностью не изученный процесс. Здесь мы остановимся только на ферментах калликреинах и, в частности, на особых регулировщиках действия этих ферментов - ингибиторах.
В действии ингибиторов следует подчеркнуть одно важное обстоятельство. Если ингибитора много - он задерживает образование активной формы фермента и тем самым снижает уровень кининов в плазме. Если же ингибитора недостаточно - калликреин дает избыточную продукцию брадикинина и каллидина. А это резко расстраивает проницаемость капилляров. Недостаточность ингибитора калликреина может быть вызвана утратой гена, ответственного за синтез определенного белка. Эта врожденная ошибка обмена ведет к чрезвычайно тяжелому наследственному заболеванию - ангионевротическому отеку. К счастью, встречается оно редко - пока известно менее 500 случаев во всем мире. Передается оно по доминантному типу и не связано с полом. Это заболевание выражается в эпизодически появляющихся острых отеках, болях в животе, рвоте. Почти одна треть больных погибает от отека гортани. Заболевание проявляется в раннем детстве и продолжается всю, к сожалению, короткую жизнь. В чем же молекулярный механизм этой ошибки обмена веществ! Приступы (острые отеки) обычно появляются после небольшого ушиба, сдавливания ткани или тяжелой физической работы. Виновником оказался ингибитор калликреина. Он содержится в коже человека, а в крови больных (и в межтканевой жидкости их кожи) его очень мало. И вот ушиб (или другой вид легкой травмы) вызывает местное воспаление, а этого достаточно, чтобы вызвать сложную цепную реакцию.
Воспалением активируется предшественник калликреина - калликреиноген плазмы крови. На месте травмы, следовательно, образуется незначительное количество калликреина. Ну, а этого вполне достаточно, чтобы образовался брадикинин (ведь ингибиторов калликреина в крови больных нет или почти нет) и развился отек. Цепной характер ответной реакции ведет к дальнейшей активации калликреина и накоплению брадикинина. Отек продолжает распространяться. Его остановит только одно обстоятельство: относительная концентрация ингибитора на краях отечной зоны может стать достаточной, чтобы блокировать действие калликреина, содержание которого в этой зоне снижено.
Местные гормоны - кинины - имеют отношение и к другим наследственным ошибкам обмена, в частности к утере одного из факторов свертывания крови (фактора Хагемана), о чем будет рассказано в дальнейшем.
А теперь обратимся к ошибкам "классических" гормонов.
Наследственный зоб - результат гормонального нарушения. Эта болезнь тесно связана с той ролью, которую в нашем теле выполняет щитовидная железа. Все гормоны щитовидной железы содержат йод, и все они являются производными тирозина. Щитовидная железа обладает способностью извлекать йод из протекающей в ней крови и интенсивно включать в тирозин и его производные. Все этапы образования гормонов находятся под контролем соответствующих ферментов, и биохимические повреждения, врожденные ошибки обмена веществ могут затрагивать разные участки. Но какой бы этап ни был задет этим дефектом, это в той или иной степени отражается на продукции гормонов щитовидной железой. Существует несколько типов наследственного зоба в зависимости от характера аномалии, лежащей в их основе: 1) нарушение превращения неорганического йода в его органическую форму, т. е. в йодосодержащее производное тирозина; 2) такое же биохимическое повреждение, но с менее тяжелыми последствиями; 3) нарушение способности продуцировать гормоны тироксин и трийод-тирозин из их предшественников - монойод- и дийодтирозина; 4) дефект фермента дейодиназы йодтирозина: 5) появление йодосодержащих пептидов, переходящих из железы в сыворотку крови.
Для распознавания этих форм заболевания пользуют ся наблюдением за передвижением в крови и щитовидной железе введенного йода с радиоактивной меткой.
Наследственный зоб не надо смешивать с благоприобретенным эндемическим зобом, вызванным недостатком йода во внешней среде. Впрочем, имеются данные, что различные семьи по-разному реагируют на этот недостаток, что, очевидно, свидетельствует о наследственном различии и чувствительности к нему. При недостатке йода ткань щитовидной железы разрастается и усиленно вырабатывает слизистую жидкость, которая растягивает фолликулы, выделяющие тиреоглобулин. В результате развивается зоб, причем вес железы может достигать 4-5 кг. Иногда железа полностью или почти полностью прекращает свою деятельность. Это приводит к микседеме.
Наследственный зоб лечат тироксином и перепаратом высушенной щитовидной железы. Если мать уже рожала детей с врожденным кретинизмом, то ей можно давать во время беременности большие дозы сухой щитовидной железы и таким образом лечить зародыш через плаценту. Плохие результаты получаются в том случае, когда лечение начато поздно, а также если оно прерывается.
Наследственный характер зоба убедительно доказан. В некоторых случаях удавалось проследить за болезнью в одной семье на протяжении более ста лет. Например, за 160 лет в одной шотландской семье в различных поколениях из 30 членов семьи было 10 кретинов. Был установлен аутосомно-рецессивный тип наследования.
По сравнению с другими наследственными болезнями зоб нельзя считать редким заболеванием. В литературе описаны сотни случаев различных форм зоба, с разной частотой проявления для каждой из них.
Ошибки стероидного обмена вызывают серьезное заболевание. Природа врожденного нарушения функции коры надпочечников, носящего название адреногенитального синдрома, заключается в ошибке обмена веществ при биосинтезе стероидных гормонов. Характерной чертой является недостаточная способность к синтезу кортизона. На это сейчас же реагирует гипофиз, который возмещает это усиленным выделением в кровь адренокортикотропного гормона - АКТГ, действующего в свою очередь на кору надпочечников. Однако вместо увеличения образования кортизона это приводит к повышению продукции половых гормонов - андрогенов. Степень нарушения синтеза кортизона может быть различной, в зависимости от этого различны и клинические проявления. Чрезвычайная выработка мужских половых гормонов приводит у женщин к псевдогермафродитизму, вирилизму, а у лиц мужского пола - к усилению вторичных половых признаков.
Что касается ошибки обмена веществ, то она выражается в наследственной недостаточности любого из четырех ферментов (дегидразы и трех разных гидроксилаз), участвующих в синтезе кортизона. Между выработкой кортизона в надпочечниках и продукцией АКТГ гипофизом существует обратная связь, поддерживающая очень подвижное равновесие. АКТГ способствует образованию кортизона, который тормозит образование АКТГ. Выпадение одного из ферментов, управляющих синтезом кортизона, нарушает это равновесие, направляет деятельность коры надпочечников по другому руслу. Начинается использование предшественников кортизона для образования мужских половых гормонов, вызывающих маскулинизацию девочек и раннюю половую зрелость мальчиков. Эта ошибка обмена наследуется рецессивно единичным геном.
Заболевание можно лечить. Чем раньше начато лечение (например, с 1-2-летнего возраста), тем лучшие результаты оно дает. Лучше всего применять кортизон. В некоторых случаях, при полной блокаде синтеза оксистероидных гормонов, расстраивается солевой обмен, а это серьезная угроза. Необходимо срочно принимать меры (вливание физиологического раствора, сывороток, введение дезоксикортикостеронацетата). Болезнь сопровождается выделением с мочой большого количества андрогенных 17-кетостероидов.
Первое описание болезни было дано 150 лет назад. С тех пор в литературе описаны тысячи случаев. В настоящее время считают, что частота гомозиготного проявления болезни составляет 1 на 67000 новорожденных.
К гормональным расстройствам относится и сахарный диабет. Выше мы упоминали о сахарном диабете и о том, что причиной его является недостаток гормона инсулина. Добавим, что в островковой ткани поджелудочной железы существуют альфа-клетки. В бета-клетках образуется инсулин, а альфа-клеткам природа поручила вырабатывать вещество с совершенно противоположным инсулину действием - гормон глюкагон. Инсулин снижает содержание сахара в крови, а глюкагон повышает. Инсулин стимулирует образование гликогена в печени, а глюкагон способствует его распаду. Поэтому можно предположить, что доля ответственности за возникновение сахарного диабета ложится на глюкагон. Ведь если альфа-клетки вдруг займутся перепроизводством глюкагона, это может повести к сахарному диабету.
Нельзя сказать, что углеводным обменом управляет инсулин. Опыты на животных показали, что сгорание глюкозы в тканях происходит и без инсулина, только в два раза медленнее. Инсулин ускоряет этот процесс только тем, что активно помогает глюкозе переходить из межклеточной жидкости в клетки.
Но все же главной причиной нарушения обмена веществ, называемого сахарным диабетом, является недостаток инсулина. Такой недостаток называют безусловным, если бета-клетки вырабатывают мало инсулина. Но может случиться и так, что выработка инсулина идет нормально, но какие-либо другие вещества (антитела) связывают его или мешают ему работать. Тогда мы имеем дело с условным недостатком инсулина.
Бета-клетки не только вырабатывают инсулин; они ведут и складское хозяйство, в котором могут накапливать до 10 мг инсулина. Если бы такое количество гормона сразу попало в кровь - это повело бы к катастрофическим последствиям. Очевидно, бета-клетки хранят его в нерастворимом состоянии. В организме имеются различные вещества, связанные с обменом глюкозы, обладающие свойством освобождать инсулин, который становится растворимым и переходит в кровь. Здесь он соединяется с белками плазмы (бета-глобулинами) и в таком виде путешествует по всему организму. Впрочем, с ним быстро расправляются протеолитические ферменты печени и почек, переводя его в бездеятельпое состояние.
Можно ли считать диабет наследственным заболеванием? Хотя единства исследователей в этом вопросе нет, но большинство все же считает, что это рецессивное заболевание. Вспомним, что частоту появления генетически обусловленного признака называют пенетрантностью гена. При истинно наследственных заболеваниях пенетрантность гена очень высока, т. е. мало зависит от воздействия других наследственных факторов и условий среды. При диабете пенетрантность гена колеблется и подвержена воздействию различных факторов. Поэтому правильнее называть диабет болезнью с наследственным предрасположением.
Многие ученые считают, что сахарный диабет обусловлен единичным геном. При гомозиготном носительстве соответствующего гена встречается тяжело протекающий детский диабет, а при гетерозиготном - значительно легче протекающий диабет взрослых. Аномальный ген, ответственный за предрасположение к диабету, широко распространен. По сведениям десятилетней давности, в США сахарным диабетом болело три миллиона человек. Массовыми обследованиями доказано, что частота диабета среди родственников больных диабетом в несколько раз выше, чем среди других людей. Кроме того, если диабетом заболевает один из однояйцевых близнецов, то почти в 2-3% случаев болезнь можно обнаружить и у другого. И все же помимо наследственности важную роль в возникновении сахарного диабета играют многие факторы.
Врачам хорошо известно, что у избыточно питающихся толстяков сахарный диабет довольно частое явление. Значительно реже болеют плохо питающиеся истощенные люди. Можно предположить, что именно в последнем случае болезнь носит наследственный характер (табл. 2).
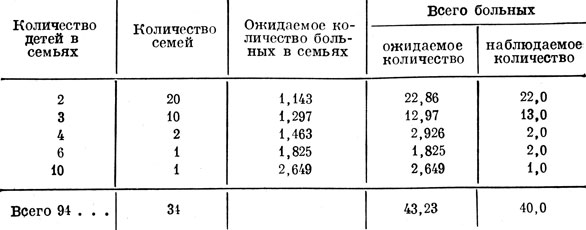
Таблица 2
Число детей, больных сахарным диабетом, соответствует рецессивному типу наследования (ожидаемое и действительное числа больных детей почти одинаковы).
Лечение заключается в умеренном образе жизни, частом и регулярном приеме необильной пищи, а также в приеме глюконата кальция, препаратов сухой щитовидной железы и рыбьего жира.
Если толстяки в большей мере подвержены диабету, при котором происходит нарушение обмена углеводов, не значит ли это, что здесь замешан и жировой обмен? Действительно, стало известно, что инсулин снижает уровень жирных кислот в крови. Главным складом жиров в нашем теле является жировая ткань. Легко понять, что в основе ожирения лежит увеличение синтеза жирных кислот, что в свою очередь сопровождается усиленным образованием из них жиров - триглицеридов. Весьма вероятно, что это обстоятельство играет роль кнута, подстегивающего бета-клетки для усиления выработки инсулина, который необходим для транспорта глюкозы в клетки жировой ткани. При таком высоком темпе в бетаклетках могут произойти нарушения и инсулин перестанет поступать в кровь.
Одна из особенностей инсулина - способность повышать проницаемость мышечных и жировых клеток для глюкозы. Инсулин как бы помогает этим тканям и органам поглощать из крови больше глюкозы, которая им очень нужна. В мышцах глюкоза доставляет энергию, необходимую для их работы. В живой ткани она служит источником такого запасного, богатого энергией вещества, как жир. Весьма вероятно, что инсулин как-то связывается с глюкозой, чтобы перенести ее внутрь клетки. Возможно, что здесь имеет значение строение глюкозы: иначе как объяснить разборчивость инсулина, который не переносит другие моносахариды (впрочем, некоторые из них, например бета-галактозу, он может переносить).
Мы уже упоминали, что глюкоза превращается в жиры - триглицериды. В состав триглицерида входят жирные кислоты и глицерин. Путь образования жирных кислот из глюкозы, лежащий через активную уксусную кислоту, сложен, и мы его касаться не будем. А вот глицерин из глюкозы образуется проще. Здесь путь лежит через предварительное образование глицерин-3-фосфата. Достаточно ферменту фосфатазе отщепить от него фосфорную кислоту, и глицерин готов. Но здесь интересно одно обстоятельство. Если мы долго питаемся преимущественно обильной жирной пищей, то при этом образование гли-церин-3-фосфата (а следовательно, и глицерина) идет недостаточно. Это резко затормаживает превращение глюкозы в жиры, и ткань замедляет поглощение сахара из крови. Другими словами, инсулин бессилен в этом случае (конечно, только в известной степени) удалять глюкозу из крови. Но когда мы питаемся преимущественно углеводами, инсулин быстро снижает содержание глюкозы в крови. И в этом случае наглядно проступает связь между обменом жиров и углеводов.
Не совсем ясен вопрос, что же происходит при сахарном диабете: полное отсутствие инсулина или перевод его в бездеятельное состояние - инактивирование? Большинство ученых придерживается второго взгляда. Многие считают, что наследственность диабета объясняется ошибкой в синтезе белков, в результате которой образуется вещество белковой (или полипептидной) природы, обладающее способностью инактивировать инсулин.
Регуляцию синтеза инсулина можно представить себе следующим образом. Генетическая контрольная система блокирует синтез инсулина, пока содержание глюкозы в крови не превышает нормы. Превышение нормы - гипергликемия - становится сигналом к "снятию" глюкозы. Синтезированный инсулин, поступая в кровь, снижает уровень сахара ниже нормы, а это по принципу обратной связи ведет снова к блокированию дальнейшего синтеза инсулина. Может быть, и в клетках нашего организма гипергликемия устраняет репрессию генов, контролирующих синтез инсулина, и путем индукции "запускает" синтез частиц инсулина? Но наш организм не бактериальная клетка, и никаких доказательств этого пока не имеется.
Хотя механизм выделения инсулина еще не выяснен полностью, но совершенно ясно, что большое значение здесь имеет состояние общего углеводного баланса организма, а этот баланс контролирует не только инсулин, но и ряд других гормонов и нервная система. Здесь надо упомянуть соматотропный гормон гипофиза, гормоны надпочечных желез (адреналин, гидрокортизон), гормон щитовидной железы (тироксин). Вспомним, что источниками глюкозы в крови являются глюкоза, образующаяся из пищи, из гликогена печени и из других веществ, например из белка (такое образование называют гликонеогенезом). Как только содержание глюкозы в крови достигнет определенного порога (120 мг%) и начинается гипергликемия, глюкоза выделяется с мочой (глюкозурия). Схему регуляции глюкозы в крови с участием гормонов представить легко. Что касается нервной регуляции, то о ней мы уже упоминали выше.
Характерный признак сахарного диабета у людей - гипергликемия, глюкозурия, жажда, похудение, выделение большого количества мочи (полиурия), упадок сил.
Недостаток инсулина не только уменьшает образование гликогена из глюкозы в печени, но и снижает интенсивность процесса фосфорилирования глюкозы в тканях, другими словами, мешает нормальному использованию этого сахара тканями. Интересно, что из всех тканей наименее чувствительной к недостатку инсулина оказалась самая важная из них - мозговая. Возможно, что это своего рода один из видов самозащиты. Во всяком случае, транспорт глюкозы внутрь нервной клетки происходит без активного участия инсулина.
Сахарный диабет расстраивает все стороны обмена веществ в организме. При тяжелой форме его в крови значительно увеличивается содержание кетоновых тел (ацетон, ацетоуксусная кислота и бета-оксимасляная кислота) и их выделение из организма. Накопление кетоновых тел в организме ведет к тяжелым последствиям - к ацидозу, вслед за которым может наступить диабетическая кома (от греческого слова "кома" - сон, дремота) - потеря сознания. В этом случае человек может погибнуть, если не принять срочные меры: введение в организм щелочи - бикарбоната натрия, но лучше инсулина.
Советские ученые устанавливают наследственный характер детской формы сахарного диабета. Для этого сопоставляют числа детей, больных сахарным диабетом, с ожидаемым количеством больных, вычисленным заранее.
Наследственная эпизодическая адинамия - болезнь аутосомно-доминантного типа. Проявляется она еще в раннем детстве в виде приступов мышечной слабости - адинамии или параличей отдельных групп мышц. Продолжительность приступов (чаще днем) от 10 до 45 минут. В отличие от периодического паралича содержание калия в сыворотке крови во время приступа не меняется, тогда как уровень фосфора и число эозинофилов понижены, как и при периодическом параличе; повышается выделение калия с мочой.
Ошибка обмена, вероятно, лежит в нарушении регулирования выделения альдостерона и гидрокортизона надпочечными железами. Прямых доказательств этого пока нет. Однако косвенно это доказывается следующим обстоятельством. Все, что обычно стимулирует повышение выделения альдостерона надпочечниками (волнения, введение глюкозы, инсулина, обильная еда ночью) или является признаком повышения продукции надпочечниками гидрокортизона (снижение числа эозинофилов в крови), в известной степени характерно и для приступов болезни. Есть предположение, что имеются нарушения и в обмене ацетилхолина, к которому больные проявляют повышенную чувствительность.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'