Ферменты
Жизнь большого города нельзя себе представить без регулировщиков уличного движения. Но никакой большой современный город не может сравниться с многоклеточным живым организмом по сложности и разнообразию протекающих в нем процессов. И, конечно, природа позаботилась о регулировщиках. При всем уважении к товарищам из ОРУДа мы вынуждены сказать, что задачи, которые ставит и разрешает природа, явно невыполнимы для них. Задача регулировать такие основные процессы жизнедеятельности, как синтез белков и нуклеиновых кислот, передача наследственных признаков, рост организмов, обмен веществ в них, старение и т. д., да еще автоматическая саморегуляция, возложена на химические вещества, которые носят название биологических регуляторов. Химическая природа большинства из них уже разгадана. Но роль, которую они выполняют в нашем теле, за последние годы раскрылась с таких неожиданных сторон, что, пожалуй, можно говорить о своего рода революции в науке о жизни.
Присмотримся же к биорегуляторам - они стоят этого. Мы ограничимся тремя группами - витаминами, гормонами и ферментами. Кроме биорегуляторов, среди которых ведущую роль играют гормоны, в нашем организме существуют еще другие виды регуляции. Самая главная из них - нервная, которая осуществляется корой (и подкоркой) головного мозга. Выражается она в том, что ход реакций обмена веществ зависит от состояния центральной нервной системы. Это чрезвычайно важный вид регуляции, но и здесь в основе лежат химические процессы.
Условимся под термином "регуляция" понимать изменение скорости - ускорение или замедление - любой биохимической реакции, протекающей в клетках нашего организма. И тут упомянем еще один интереснейший вид саморегуляции - автоматическую регуляцию, в основе которой лежит принцип обратной связи, заключающейся в том, что концентрация вещества в клетке дает сигнал к пуску регулирующих процессов.
С конкретными примерами саморегуляции мы встретимся в дальнейшем.
На какое-либо внезапно возникшее воздействие обмен веществ в клетке отвечает срочной регуляцией без существенной перестройки своих механизмов и резервов. Но вот мы выезжаем в горы и остаемся там на длительное время. В этих условиях клетки нашего тела перестраиваются основательным образом, синтезируют новые белки и другие вещества и т. д. Такую регуляцию можно назвать длительной: она служит для приспособления нашего организма к новым для него условиям.
Когда группа туристов совершает переход, общая скорость его явно зависит от самого медленного участника группы. Так и в клетке самая медленная биохимическая реакция ограничивает скорость всего цикла связанных с ней реакций. Это тоже своеобразный вид регуляции.
И тут, пожалуй, уместно обратиться к молекулярной биологии - науке, бурно развивающейся в последние годы и занимающейся изучением всего живого на молекулярном уровне, другими словами, изучающей реакции между молекулами в живом организме. Чем отличаются реакции в живом организме от подобных реакций в неживой природе?
На это, несколько упрощая, можно кратко ответить: скоростью реакций, катализируемых специальными ускорителями - ферментами, и упорядоченностью, потому что в неживой природе реакции протекают на основе сталкивания беспорядочно рассеянных в пространстве молекул. В простейшей же представительнице живого мира - клетке - молекулы пространственно закреплены на матрице, а это обеспечивает не только строго определенное направление химической реакции, но и необычайную скорость таких реакций,
Обмен веществ в простейшем одноклеточном организме регулируется путем изменения скорости ферментативных реакций. Такая клетка может существовать, приспосабливаясь, т. е. адаптируясь, к условиям внешней среды. Она адаптируется, мобилизуя по мере надобности свои ферменты, часть которых при обычных условиях, вероятно, находится в резерве.
Но наш организм состоит из триллионов клеток, неспособных к самостоятельному существованию. Их объединяет одно качество: все они участвуют в общем обмене веществ, в котором скорость ферментативных реакций регулирует центральная нервная система. Она осуществляет это в тесном контакте с железами внутренней секреции и их гормонами.
Мы уже говорили выше о процессах, идущих в организме при помощи ферментов. Один из самых мощных механизмов регулирования, используемых центральной нервной системой, - нервные импульсы, постоянно поступающие в ткани нашего тела. Они обеспечивают упорядоченный (т. е. матричный) синтез белков, в частности белков-ферментов, поддерживают химическую организацию клеток и их способность воспринимать "указания" главного регулятора.
Итак, катализаторы-ферменты ускоряют (или замедляют) ход уже начавшейся химической реакции. Впрочем, по мнению некоторых ученых, ферменты обладают способностью и начинать эти реакции. Очень важно также то, что фермент настолько повышает скорость какой-либо одной реакции, что она идет по определенному пути. Другими словами, фермент препятствует побочным реакциям и определяет направление, по которому идет главная химическая реакция. Это очень важное свойство ферментов, о котором еще будет идти речь ниже. В настоящее время термины "фермент" и "энзим" используются как однозначные, так как установлено, что никаких различий между внутриклеточными и внеклеточными ферментами нет. Это дало возможность внести определенный порядок в наименование многочисленных ферментов, известных в настоящее время. Биохимики стараются в названии фермента отразить механизм его действия. Мы воздержались от этого, поскольку, например, вместо "алкоголь-дегидрогеназа" пришлось бы привести название: "алкоголь-никотинамид-аденин-динуклеотид-трансгидрогеназа"*, что, конечно, сделало бы невозможным популярное изложение. Ограничимся указанием, что Международный союз биохимиков принял следующее подразделение ферментов на шесть классов: 1) оксидоредуктазы, катализирующие процессы биологического окисления; 2) трансферазы, переносящие группы атомов; 3) гидролазы, катализирующие расщепление с приспособлением воды; 4) лиазы, отщепляющие (или присоединяющие) различные группы без участия воды; 5) изомеразы, превращающие одно в другое сходные ("изомерные") соединения, и 6) лигазы, связывающие друг с другом две молекулы при разрыве связи в некоторых соединениях фосфорной кислоты.
*(Обычно ферменту дают название, добавляя окончание "аза" к латинскому корню слова, обозначающего вещество, на которое действует фермент, либо к названию процесса, который катализируется данным ферментом. Наряду с этим пока еще есть много ферментов с произвольными исторически сложившимися и устоявшимися названиями.)
1. Оксидоредуктазы - ферменты, катализирующие окислительно-восстановительные реакции. Эта большая группа ферментов, присутствующих во всех тканях, включает несколько подгрупп:
а) дегидрогеназы - ферменты, катализирующие окисление вещества путем переноса водорода с одного субстрата на другой. В зависимости от субстрата, окисление которого катализирует данная дегидрогеназа, она и получает свое полное наименование. Например, алкогольдегидрогеназа, глицерофосфатдегидрогеназа, лактатдегидрогеназа (окисляющая молочную кислоту), глютаматдегидрогеназа и т. д.
Акцептором водорода (т. е. веществом, принимающим водород) в реакциях, катализируемых этими ферментами, служат НАД и НАДФ. Существует также ряд дегидрогеназ, участвующих в транспорте электронов от восстановленных форм никотинамиддинуклеотидов по системе цитохромов, например НАД·Н2-цитохром с-оксидоредуктаза, НАД·Н2-цитохром-в-5-оксидоредуктаза и др.;
б) оксидазы - ферменты, переносящие водород с окисляемого субстрата на кислород. Среди них следует указать оксидазу аминокислот, моноаминооксидазу, пиридок-сальаминооксидазу, цитохромоксидазу, а также ферменты, катализирующие транспорт водорода от субстрата на перекись водорода - пероксидазу - и разлагающие перекись водорода с образованием кислорода и воды - каталазу.
2. Трансферазы - обширная группа ферментов, ускоряющих перенос атомов или групп атомов и радикалов одного субстрата на другой. Она может быть разделена па следующие подгруппы:
а) метилтрансферазы - ферменты, переносящие метильную группу - СН3. К числу их относятся никотинамидметилтраисфераза, сериноксиметилтрансфераза и др.;
б) ацилтрансферазы - ферменты, переносящие кислотный остаток. Примерами ферментов этой подгруппы могут служить холинацетилтрансфераза, ацетил-КоА-ацилтрансфераза и др.;
в) гликозилтрансферазы - ферменты, переносящие остаток моносахарида - гликозил. К числу этих ферментов относится фосфорилаза, переносящая остаток глюкозы от молекулы гликогена на фосфорную кислоту с образованием глюкозо-1-фосфата, фосфорибозилтрансфераза, аденозилфосфорилаза и другие ферменты;
г) амипотрансферазы - ферменты, переносящие аминогруппу с аминокислот на кетокислоты. Важнейшими из них являются: аспарттаминотрансфераза, аланинаминотрансфераза, тирозинаминотрансфераза;
д) фосфотрансферазы - ферменты, переносящие остаток фосфорной кислоты, как правило, с фосфоросодержащих соединений на нуклеотидфосфаты. В эту обширную подгруппу ферментов входят: гексокиназа, фруктокиназа и фосфофруктокиназа, переносящие фосфатный остаток с аденозинтрифосфорной кислоты соответственно на глюкозу, фруктозу или фруктозо-6-фосфат; креатинкиназа, катализирующая обратимый перенос фосфатного остатка с креатинфосфата на аденозиндифосфорную кислоту; пируваткиназа, переносящая фосфатный остаток с фосфоенолпировиноградной кислоты на аденозиндифосфорную кислоту, и многие другие ферменты;
е) сульфидтрансферазы - ферменты, переносящие группы с атомом серы. Например, оксалат-КоА-трансфераза, КоА-трансфераза-кетокислот;
ж) амидинтрансферазы - ферменты, переносящие амидиновую группу -CNH2 = H. К ним относится, например, аргининглицинамидинтрансфераза, переносящая амидиновую группу с аргинина на глицин при синтезе креатина.
3. Гидролазы - ферменты, катализирующие при участии воды расщепление сложных органических соединений (белков, жиров, липоидов, полисахаридов) по месту эфирной или пептидной связи. Эта большая группа ферментов, присутствующих в различных тканях, в зависимости от природы гидролизуемого субстрата может быть разделена на несколько подгрупп:
а) эстеразы - ферменты, катализирующие гидролиз сложных эфиров (жиров, фосфатидов и др.). К ним относятся такие ферменты, как гидролизующая жиры липаза, фосфолипаза А, ацетилхолинэстераза, холинэстераза и др.;
б) гидролазы фосфомоно-и-диэфиров - ферменты, катализирующие отщепление фосфорной кислоты от различных соединений (нуклеотидов и нуклеиновых кислот, фосфорных эфиров углеводов). Важнейшими из них являются: щелочная фосфатаза, кислая фосфатаза, глюкозо-6-фосфатаза, глюкозо-1-фосфатаза, фосфодиэстераза, дезоксирибонуклеаза;
в) глюкозидазы - ферменты, участвующие в гидролизе глюкозидов ди-, три- и полисахаридов (гликогена, крахмала, сахарозы, мальтозы и др.). К ним относится амилаза, галактозидаза, нуклеозидаза и другие ферменты;
г) пептидгидролазы - ферменты, катализирующие гидролитическое расщепление белков и полипептидов по месту пептидной связи. К ним относятся аминопептидаза, карбоксипептидаза, пепсин, трипсин, хпмотрипсин, энтеропептидаза, катепсин и т. д.;
д) амидазы - ферменты, катализирующие гидролитическое отщепление аминогруппы от амидов, пуринов, нуклеотидов и других соединений. К ним принадлежат аспарагиназа, глютаминаза, адениндезаминаза, АМФ-дезаминаза, гидролитически отщепляющие аминогруппы от амидов аспарагиновой и глютаминовой кислот, от аденина и аденозинмонофосфорной кислоты; уреаза, разлагающая мочевину на СО2 и две молекулы NH3, и другие ферменты;
е) полифосфатазы - ферменты, гидролизующие фосфоангидридные связи. Важнейшие среди них: аденозинтрифосфатаза, нуклеотид-пирофосфатаза, неорганическая пирофосфатаза.
4. Лиазы - ферменты, отщепляющие от субстрата негидролитическим путем ту или иную группу или расщепляющие углеродную цепь. К ним относятся, например, пируватдекарбоксилаза, ферменты, декарбоксилирующие карбоновые кислоты, альдолаза, расщепляющая фруктозо-1-6-дифосфат на две фосфотриазы, и др.
5. Изомеразы - ферменты, катализирующие реакции внутримолекулярного перемещения различных групп. К этим ферментам относятся глюкозофосфат-изомераза, триозофосфат-изомераза, фосфоглицерат-мутаза.
6. Лигазы, или синтетазы, - ферменты, катализирующие реакции биосинтеза за счет энергии АТФ или других нуклеотидтрифосфатов. Сюда относятся ферменты, синтезирующие ди- и полисахариды, жиры и липоиды, белки, нуклеиновые кислоты, а также ряд промежуточных продуктов обмена веществ - соединение аминокислот с т-РНК, остатков жирных кислот (ацилов) с коэнзимом А и т. п.
Ферменты с одинаковым типом функциональной активности, т. е. катализирующие одну и ту же реакцию, но отличающиеся белковым компонентом, получили название изоферментов. Они различаются между собой аминокислотным составом, адсорбционными, иммунохимическими и кинетическими свойствами, термостабильностью, оптимумом рН и другими особенностями. В организме человека и животных выявлено много ферментов, состоящих из изоферментов. Среди них следует назвать лактатдегидрогеназу, глюкозо-6-фосфат-дегидрогеназу, малатдегидрогеназу, креатинкиназу, фосфатазу, амилазу, гексокиназу. Так изучено пять изоферментов лактатдегидрогеназы, различающихся по чередованию полипептидных цепей. Белковая молекула этих изоферментов состоит из четырех полипептидных цепей, которые могут быть двух видов - Н и М ("Н" - начальная буква в слове heart, "М" - в слове muscle). В сердечной мышце лактатдегидрогеназа построена из четырех полипептидных цепей вида Н, т. е. ее молекула состоит из H4. В скелетной мышце фермент состоит только из полипептидных цепей вида М, т. е. М4. В других органах молекулы лактатдегид-рогеназы различаются соотношением этих полипептидных цепей: H3, М, Н2, М2, Н, М3*.
*(Для некоторых изоферментов удалось доказать наличие различий в первичной и во вторичной структуре.)
Для выявления изоферментов с большим успехом применяют метод электрофореза экстракта ткани или сыворотки крови. В силу различий в величине заряда белковых молекул отдельные изоферменты передвигаются в электрическом поле с разной скоростью и могут быть отделены друг от друга.
Присутствие в отдельных органах специфических изоферментов имеет важное диагностическое значение и используется в клинической биохимии для выявления патологических процессов. Повышение уровня отдельных изоферментов или изменение ферментного спектра в крови является настолько специфическим, что может служить решающим подтверждением клинического диагноза.
Специфичность ферментов - явление весьма примечательное. Пожалуй, самое удивительное - специфичность действия ферментов, осуществляющих синтез белков.
Говоря о белках и нуклеиновых кислотах, мы упоминали об этом синтезе. Но здесь необходимо подчеркнуть необычайную способность участвующих в синтезе ферментов узнавать одну аминокислоту среди двух десятков прочих. Более того, они могут распознавать соответствующую РНК по меньшей мере среди 20 ее разновидностей.
Одно из важнейших достижений последних лет - выяснение того обстоятельства, что специфичность ферментных белков зависит от порядка чередования в них аминокислот, из которых складывается пептидная цепь. Таким образом удалось установить, что не только молекула фермента рибонуклеазы состоит из 124 аминокислотных остатков, образующих одну пептидную цепь, но и выяснить, какие именно аминокислоты образуют эту цепь и в какой последовательности чередуются друг с другом.
Удалось также выяснить, что специфичность фермента зависит не только от того, как расположены аминокислоты в его молекуле. В каждом ферменте имеется своего рода активный центр - небольшой участок пептидной цепи с характерным для него порядком чередования аминокислот. Можно расколоть молекулу фермента, отбить от нее осколок, сохранить всю специфичность действия фермента. Такие опыты пока еще не удалось осуществить в больших масштабах, но главное сделано: снята завеса с явления непонятной до того разборчивости биологических катализаторов, делавших их загадочными веществами.
В активном центре фермента имеется участок, контуры которого соответствуют очертаниям молекул субстрата, или, как говорят, комплементарен им. Такой участок называют контактной площадкой фермента. В процессе образования комплекса фермент - субстрат очертания их молекул могут изменяться, как бы приспосабливаясь друг к другу (рис. 28).
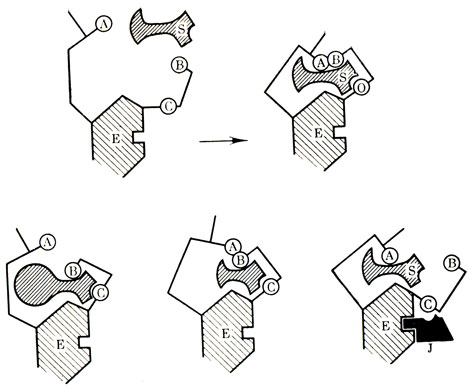
Рис. 28. Модель Кошланда (вариации при разных заболеваниях)
Не надо думать, что в молекуле фермента "работает" только небольшой ее кусочек - активный центр. К этому вопросу мы еще вернемся несколько ниже. Отметим пока, что активный центр вызывает изменения определенного вещества - субстрата.
С помощью рентгена удалось даже сфотографировать процесс работы некоторых ферментов. Оказалось, что половинки молекулы как бы охватывают субстрат с обеих сторон.
Кроме активного центра в молекуле фермента имеется уязвимое место - химическая группировка, которую могут блокировать самые разнообразные вещества, не имеющие никакого родства с субстратом, на который действует активный центр. Блокируя эту группировку -- ученые называют ее "аллостерической"*. вещества могут воздействовать на общее строение белковой молекулы - ее конформацию - и тем самым регулировать деятельность активного центра, т. е. основную работу фермента. Самое интересное здесь в том, что среди таких веществ встречаются гормоны - возбудители и регуляторы деятельности важнейших органов нашего тела.
*(Аллостерический - структурно не связанный. Вещества, которые по своей структуре отличаются от субстрата и могут регулировать активность фермента, называют аллостерическими эффекторами (исполнителями).)
Если это так, то мы находимся на подступах к переводу на язык химических понятий (другими словами, к полной расшифровке) таких функций нашего тела, как рост и созревание, половое развитие и размножение, и многих других процессов, которыми ведают гормоны. А отсюда "два шага" до искусственного воссоздания этих процессов.
Аллостерия - прекрасный пример того, как замечательно отрегулировали химические процессы в нашем теле (да и во всей живой природе) ферменты, катализирующие химические превращения субстрата. Назовем его живой системой. Получается, что работа регулируемой живой системы зависит от результатов ее же собственной деятельности. Предположим, что живая система состоит из целого ряда химических реакций, каждая из которых катализируется особым ферментом. Конечный продукт не имеет ничего общего с начальным субстратом, но он может блокировать действие начального фермента, катализирующего первую реакцию в цепи данной живой системы.
Как назвать это явление? На это может ответить и школьник - обратной связью. Да, именно той обратной связью, которая лежит в основе простого способа регуляции любой машины.
Ферментные белки - обычные органические соединения, специфичность действий которых зависит от особенностей их химического строения и пространственного расположения (структуры).
Нет правил без исключения. И высокая специфичность биологических катализаторов требует оговорки. Дело в том, что известны случаи, когда один и тот же фермент действует на несколько различных химических субстратов. Такие ферменты встречаются в пищеварительном тракте. Это и понятно. Пища содержит столько разнообразных веществ, что ферментам тут уже не до разборчивости - только успевай справляться со всеми! Но такие примеры сравнительно редки, и избирательность действия ферментов остается пока наиболее характерным их свойством*. Подчеркнем слово "пока". Дело в том, что в последние годы ученые получили довольно неожиданные данные, несколько поколебавшие уверенность в обязательной специфичности действия ферментов.
*(В живых организмах (в том числе и у человека) встречаются ферменты, которые могут действовать на вещества, совершенно не встречающиеся в природе. К таким веществам можно отнести многие лекарственные вещества и яды. Весьма вероятно, что устойчивость болезнетворных микробов к таким лекарственным веществам объясняется тем, что микроорганизмы вырабатывают специальные ферменты, разрушающие эти лекарственные вещества.)
Со специфичностью действия ферментов хорошо согласуется еще одно обстоятельство. Оказывается, активность фермента можно повышать или, напротив, угнетать, подавлять и даже парализовать действием некоторых химических веществ, часто очень простых по составу. Такие активаторы и парализаторы действия ферментов - их называют ингибиторами - могут быть очень специфичными. Так, например, соль сильной кислоты резко повышает активность фермента папаина, но совершенно парализует действие дыхательного фермента.
Подобные явления играют большую роль в живом организме. Дело в том, что многие ферменты содержатся в тканях и клетках организма в совершенно неактивном состоянии, но в определенных условиях становятся активными.
Это впервые показали и И. П. Павлов и его ученики на примере ферментов пищеварения.
В здоровых железах желудка нет готового активного пепсина, а имеется недеятельный пропепсин - пепсиноген. Под влиянием нервной деятельности железы выделяют в полость желудка этот неактивный профермент, который под действием соляной кислоты желудочного сока тут же превращается в пепсин. Образовавшийся пепсин помогает соляной кислоте превращать пепсиноген в пепсин. Так происходит активирование фермента. Здесь роль активатора играет хорошо всем известная соляная кислота. Эта ее роль очень важна для нормального пищеварения в желудке.
Иногда активаторы ферментов еще проще по составу, чем соляная кислота. В некоторых случаях для проявления действия фермента достаточно присутствия небольших количеств кальция, марганца, кобальта. Амилаза, например, активируется в присутствии хлоридов. В других случаях для активирования фермента клетки нашего тела вырабатывают очень сложные по составу белковые вещества. Фактически такой активатор является ферментом фермента, так как катализирует действие его недеятельной формы. Так, например, трипсин, расщепляющий в кишечнике белки, существует в клетках в виде неактивного трипсиногена, который активируется действием энтерокиназы.
Как представить себе сущность активации? В ряде случаев удалось установить, что возникновение активности зависит от первичной структуры белка. Возьмем тот же трипсиноген. Он неактивен. Но вот от его полипептидной цепочки (первичной структуры) отщепляется отрезок, состоящий из шести остатков аминокислот. И сразу же проявляется ферментативная активность - трипсиноген становится настоящим трипсином. Чем это можно объяснить? Оказывается, что после "ампутации" первичной структуры, соответствующий участок полипептидной цепочки начинает закручиваться в спираль, в результате чего и появляется ферментативная активность. Следовательно, первичная структура "знает", как образовать активный центр в "полноценном" белке-ферменте, и свое знание (информацию) автоматически передает вторичной и третичной структуре белка-фермента. Теперь понятно, что природа не так расточительна, как это казалось лет десять назад. Ученые тогда недоумевали: если активен только кусочек молекулы фермента, то чему служит вся остальная ее часть? Не лишняя ли она? Оказывается нет.
Для осуществления синтеза определенного белка-фермента необходима вся его полноценная молекула, так как в ней заключена информация, необходимая для правильного построения новой молекулы с характерными для нее активными центрами.
Интересно, что нередко активация профермента осуществляется образующимся из него ферментом. Скорость такого аутокаталического (самоускоряющего) процесса сильно увеличивается.
Действие активаторов и ингибиторов играет большую роль в регулировании ферментативных реакций в протоплазме клетки*. Наряду с этим активность ферментов в живой клетке регулируется и другим путем. Было установлено, что ферменты могут связываться с другими белками и снова освобождаться из таких соединений. Связываясь, ферменты теряют свою активность**, освобождаясь, - восстанавливают ее. А так как протоплазма клетки состоит из белков, то регулирование деятельности ферментов во многом зависит от способности их оседать на белковых частичках протоплазмы и освобождаться от них.
*(Деятельность многочисленных ингибиторов, содержащихся в живой клетке, очень часто полезна для организма. Они как бы задерживают фермент и снова выпускают его в определенное время и в определенном направлении, способствуя общей регуляции химизма.)
**(Обычно ингибитор по своим очертаниям похож на субстрат и может, как бы обманывая фермент, конкурировать с этим субстратом, временно захватывать контактную площадку, замедляя таким образом течение ферментативной реакции. Такие ингибиторы называют конкурентными. Встречаются и неконкурентные ингибиторы, которые так прочно захватывают контактную площадку, что фермент окончательно выходит из строя. Недавно показано, что ингибитор трипсина образует комплекс с частью молекул фермента, которая состоит из 50 аминокислотных остатков и остатка аминокислоты серина, входящей в активный центр трипсина. Новейшие исследования показывают, что в составе изоферментов могут быть существенные отличия. Указывается также на возможность существования "конформеров", т. е. форм фермента, обладающих одинаковой первичной структурой и отличающихся только по конформации молекулы.)
Очевидно, многие ферменты в живой клетке находятся в виде проферментов. Иначе нельзя было бы понять, каким образом "волки и овцы" - фермент и субстрат, на который он должен действовать, - мирно уживаются друг с другом в живой клетке. Так, например, в любой растительной клетке нетрудно обнаружить крахмал и рядом с ним амилазу - фермент, который расщепляет крахмал. В этом играет роль способ активации ферментов. Кроме того, часть полипептидной цепочки профермента может держать активный фермент "на привязи", а отрываясь, выпускать его "на волю". Так происходит, например, образование активного пепсина из пепсиногена. Возможно также, что между ферментом и субстратом в живой клетке имеются какие-либо пространственные ограничения.
Важную роль играют антиферменты - вещества, прекращающие или задерживающие действие ферментов. Природа антиферментов пока не выяснена. Известно только, что каждый из них задерживает действие определенного фермента. Так, например, выделившийся в желудке пепсин не переваривает клетки "своего" желудка, но если человек съест желудок какого-либо животного, то "свой" пепсин будет переваривать его клетки. Очевидно, в клетках желудка содержится антипепсин, мешающий перевариванию их собственным пепсином. Это же можно допустить и в отношении других пищеварительных желез и кишечной стенки, устойчивых к действию "своих" ферментов.
Для упомянутого выше фермента трипсина известен антифермент - антитрипсин. Соединяясь с трипсином, ингибитором которого он является, антитрипсин предохраняет поджелудочную железу от самопереваривания*. Антитрипсин имеется у глистов, живущих в кишечнике человека. Благодаря ему глисты не перевариваются трипсином поджелудочного сока, изливающегося в кишечник. Антитрипсин встречается и в сыворотке крови. Если ввести в организм прямо в кровь какой-либо фермент, то в нем образуется соответствующий антифермент, например антикаталаза или антиуреаза. Очевидно, антиферменты защищают организм от чуждых ему ферментов, в том числе и ферментов болезнетворных бактерий. В этом случае антиферментам дают общее название - антитела.
*(Можно допустить и другое объяснение. Известно, что некоторые ферменты присутствуют в клетке в неактивной "замаскированной" форме. Когда организм погибает, его клетки подвергаются саморазрушению - автолизу. В этом случае с ферментов как бы спадает маска, и они становятся активными. К сожалению, такое явление может произойти и в живом теле с катастрофическими для него последствиями: например при некрозе поджелудочной железы, вызываемом самоактивацией пищеварительных ферментов.)
Ферменты широко распространены в живой природе. Практически они содержатся во всех живых и растительных клетках. Это позволяет предположить, что все белки организма могут быть ферментами. Такой взгляд подтверждает открытие советских ученых В. А. Энгельгардта и М. Н. Любимовой (1939).
Как известно, наиболее важная составная часть мышц, обусловливающая их способность сокращаться, - миозин. Но оказалось, что миозин одновременно является и ферментом, который катализирует химическую реакцию доставляющую необходимую для сокращения энергию. Такое самоснабжение энергией - факт весьма примечательный. Вполне вероятно, что все белки - ферменты, но не для всех белков выявлены их ферментативные свойства. Возможно, все или почти все белки приобретают каталитические свойства, т. е. становятся ферментами в определенных условиях.
Различия между отдельными ферментами сказываются и в их способности быть простыми и сложными белками. Для простых белков характерно то, что при расщеплении из них не удается получить ничего, кроме аминокислот. Следовательно, их отличие друг от друга состоит в различном наборе и порядке чередования аминокислот в молекуле. К простым белкам относится большая часть известных ферментов - протеазы, амилазы, карбогидразы, эстеразы. Некоторые ферменты помимо белка содержат еще более простые соединения, иногда одни и те же у различных ферментов. Так, например, в составе окислительных ферментов (к которым можно причислить и красящее вещество крови - гемоглобин) содержится органическое соединение железа. В состав других ферментов входят медь*, цинк, марганец, ванадий, хром, сера. Эти ферменты являются сложными белками - протеидами, содержащими небелковые, так называемые простетические группы. К протеидам относятся и фосфорилазы.
*(Ионы металлов часто как бы побуждают фермент к деятельности, являясь активаторами, переводящими фермент в каталитически активное состояние.)
Простетические группы не всегда содержат металлы. Выдающийся советский ученый Н. Д. Зелинский предположил, что в состав ферментов могут входить такие широко известные соединения, как витамины. Предположение ученого блестяще подтвердилось в отношении почти всех витаминов. Это очень важное обстоятельство, помогающее понять физиологическое действие витаминов.
В роли простетических групп могут выступать и другие органические соединения. Все небелковые части ферментов удобно называть коферментами, или кофакторами. Белковую часть молекулы принято называть носителем, или апоферментом, а простетическую группу - активной группой. Необходимо, однако, помнить, что характер, специфичность и само действие зависят главным образом от природы белкового носителя, соединенного с активной группой. Другими словами, от носителя зависит, на какое именно вещество действует фермент: на углеводы, жиры, белки или на какие-нибудь другие вещества. Но и коферменты не остаются бездеятельными. Именно они являются переносчиками различных атомов (водорода) или атомных группировок в ферментативных реакциях. Коферменты играют также видную роль в обеспечении согласованной деятельности различных ферментов. Наконец, коферменты могут регулировать процессы обмена веществ. Это происходит путем изменения их концентрации в клетке. Иногда пути обмена веществ расходятся, и нескольким апоферментам становится нужен один и тот же кофермент. Происходит ожесточенная конкуренция, отражающаяся на скорости реакции. Другими словами, и здесь мы имеем дело со срочной регуляцией.
В состав важнейших коферментов входят различные витамины, вернее, их производные. Сокращенные названия таких коферментов - НАД, НАДФ, КоА - будут расшифрованы по мере надобности в дальнейшем.
Как уже было упомянуто выше, ферменты играют важнейшую роль в обмене веществ - этом сложном непрерывно протекающем в живом организме процессе, с прекращением которого прекращается существование живого организма.
Сложность химических процессов в живых организмах хорошо иллюстрируется тем фактом, что в них участвуют самые различные соединения: вода, минеральные соли, жиры и жироподобные вещества, углеводы, витамины, гормоны, белки. В центре всех химических превращений находятся белки-ферменты. Определяя скорость биохимических реакций, ферменты влияют и на их направленность. А ведь направление, по которому пойдет какое-либо вещество в процессах химических превращений обмена, зависит от того, по какому пути это вещество пойдет скорее. Благодаря избирательности действия решающая роль здесь принадлежит ферментам: ведь из многих возможных химических реакций фермент ускоряет во много раз обычно лишь одну.
Таким образом, ферменты направляют и регулируют химические превращения обмена веществ в организме, обеспечивают его связь с внешней средой и приспособленность к ее условиям. Важную роль играет и то обстоятельство, что в процессах обмена веществ ферменты изменчивы, они могут возникать, изменяться, терять свои каталитические свойства.
Несмотря на большое количество ферментов или, как говорят, различных ферментных систем, тысячи ферментных реакций в живом организме протекают удивительно слаженно, в строго определенной последовательности. Именно такая взаимозависимость и координация действия многочисленных ферментных систем обусловливают нормальное течение химических реакций в здоровом организме. Поэтому очень важно изучать не только действие отдельных ферментов, но и совокупность ферментных систем в целом. Здесь имеется ряд трудностей, которые постепенно преодолеваются. Мы уже можем себе до некоторой степени представить, как функционируют ферменты. Можно предположить, что сначала фермент соединяется с субстратом, образуется как бы промежуточное соединение, которое, распадаясь, дает уже конечный продукт реакции. Молекула самого фермента после этого восстанавливается, хотя иногда может подвергнуться частичному разложению.
Связь между действием двух и более ферментов осуществляется различными способами. Например, одно и то же вещество может быть общим субстратом для обоих ферментов или же конечный продукт, возникающий в результате действия одного фермента, становится исходным субстратом действия другого фермента. Легко понять, что если одна из связанных вместе ферментных стем остановится, то остановится и другая. Причины этого нарушения деятельности ферментов различны. Например, взаимозависимость может обусловливаться и по линии субстратов (конечный продукт одной системы является начальным субстратом для другой), и по линии обеспечения энергией обеих ферментных систем (первая система может доставлять энергию, необходимую для функционирования второй). Полного объяснения действия ферментов пока еще не существует, как, впрочем, не существует и окончательной теории действия катализаторов вообще.
Изучение удивительной согласованности действия ферментов в живом организме представляет интерес не только для биохимиков, но и для врачей, технологов и других специалистов. Еще два века назад М. В. Ломоносов писал, что "медик без довольного познания химии совершен быть не может". Эти слова - пример замечательного научного предвидения, оправданные всем ходом развития биохимии, - находят постоянное подтверждение и в новейших открытиях в области ферментов. Еще не так давно о соляной кислоте знали, что она необходима как активатор фермента желудочного сока - пепсина. Оказалось, что поступление соляной кислоты в желудочный сок обеспечивается действием специального фермента, способствующего ее выработке.
Все мы со школьной скамьи знакомы с той ролью, которую в нашем организме играет красящее вещество крови - гемоглобин. Она заключается в связывании кислорода воздуха и доставке в ткани нашего тела. Механизм связывания кислорода гемоглобином был так хорошо изучен, что никто не сомневался в зависимости этого процесса от давления кислорода во вдыхаемом воздухе. Законы физики, вернее физической химии, казалось бы, объясняли этот процесс полностью. Но несколько лет тому назад и для этого процесса был обнаружен в крови специальный фермент - глобиноксидаза.
Таким же физико-химическим процессом до недавнего времени считали освобождение в крови углекислого газа из солей угольной кислоты - бикарбонатов. Оказалось, однако, что и этот простой химический процесс катализируется особым ферментом - угольной ангидразой (карбоангидразой) - ферментом, в составе которого был обнаружен цинк.
Нет сомнений, что ближайшие годы принесут новые доказательства повсеместности участия ферментов во всех химических превращениях в жидкостях и тканях нашего тела. Ни одно заболевание не проходит без нарушений в химических процессах обмена веществ и, следовательно, без нарушений в деятельности ферментов, которая в живых клетках здорового организма отличается глубокой взаимосвязанностью и удивительной согласованностью. Естественно, что у врачей возникла мысль использовать ускорители химических реакций - ферменты - для лечения больных. Особенно широкое распространение получило лечебное применение ферментов, содержащихся в пищеварительных соках: пепсина, трипсина, химотрипсина. С лечебной целью применяются и препараты многих других ферментов. Так, гиалуронидаза - фермент, разрушающий межклеточное вещество, - используется для ускорения всасывания лекарственных веществ, вводимых под кожу или внутримышечно. Грозное заболевание - тромбоз, лечат с помощью плазмина. Этот фермент, образующийся из неактивного профермента - плазминогена, обладает способностью как бы растворять тромбы. Препараты дыхательных ферментов врачи применяют там, где организму грозит кислородное голодание и т. д.
С лечебной целью применяются не только ферменты-белки, но и те небелковые соединения - коферменты, которые входят в состав различных ферментативных систем. В составе коферментов имеются многие (возможно, и все) из хорошо известных витаминов - органических соединений, недостаточность или отсутствие которых в пище вызывает нарушение нормального обмена веществ и заболевание организма. Лечить такие заболевания, казалось бы, простое дело: устранить недостаточность витамина (или витаминов), давая их больному в больших количествах. Однако в тех случаях, когда витамин входит в состав кофермента, этого недостаточно. Если белковая часть фермента разрушена, то введение в организм больших количеств кофермента, т. е. витамина, не дает желаемого эффекта. Следовательно, в первую очередь надо устранить белковое голодание, способствовать нормализации процессов создания необходимых организму белков, заботиться о соответствующем белковом составе пищи.
Коферменты широко используются с лечебной целью, главным образом в тех случаях, когда их недостаточность вызывает нарушение обмена веществ вследствие расстройства деятельности соответствующих ферментов. Достаточно упомянуть о коферментах, содержащих витамин B1, тесно связанных с ферментативными превращениями углеводов, витамин В2 (рибофлавин) - с окислением, никотиновую кислоту - с дыханием тканей. Эти и другие коферменты прочно вошли в арсенал лечебных средств современной медицины. Недаром они попали в "первую десятку" наиболее ценных лекарственных веществ современности. Это объясняется тем, что они призваны действовать не на симптомы болезни, а на самые интимные и действенные ее причины - нарушения в обмене веществ.
Как обстоит дело с химическим синтезом ферментов, т. е. с получением их в лабораториях без помощи живых организмов?
Мы упоминали о том, что ферменты - это белки и, следовательно, получение искусственных ферментов является проблемой синтеза белка. Эта проблема почти решена. Химикам удалось сначала точно установить химическое строение некоторых простейших белковоподобных соединений и затем искусственно их воссоздать. Полученные вещества обладали важными биологическими свойствами. Пока таким путем получены как бы белки-малютки, молекула которых сравнительно мала. Правильнее было бы назвать их не белками, а обломками. Такой переходной ступенью от аминокислот к белкам можно считать полипептиды, в которых несколько аминокислотных остатков связаны друг с другом по такому же типу, как и в белках.
Не являясь белками, полипептиды напоминают их некоторыми свойствами. Поэтому, осуществив синтез полипептидов, химики захватили подступ к синтезу искусственного белка. Напомним, что недавно осуществлен и первый полный синтез молекулы белка первостепенной важности - инсулина (гормона, управляющего углеводным обменом в нашем теле). Нет никакого сомнения, что получение искусственных ферментов - дело ближайших лет. Поскольку хорошо изучено химическое строение именно тех белков, ферментные свойства которых известны, можно с уверенностью сказать, что среди первенцев искусственного синтеза белков будут находиться ферменты. Таким образом будет достигнута цель - получение синтетических ферментов, подобных по своим свойствам природным ферментам.
Ферменты - высокомолекулярные соединения, их молекулы - гиганты. Химики научились искусству брать молекулы, поворачивать нужной стороной, скреплять друг с другом и создавать таким путем гигантские молекулы с заданными свойствами. В недалеком будущем станет реальностью создание искусственных ферментов с теми свойствами, которые захочет придать им человек.
Из сказанного выше вытекает, что в живом организме идут превращения веществ, поступающих из внешней среды, и выделение продуктов этих превращений. Так происходит обмен веществ между организмом и внешней средой. Благодаря обмену наш организм получает энергию, необходимую для жизни. Благодаря ему происходит также постоянное восстановление тканей тела, разрушающихся в процессе жизнедеятельности. Но обмен веществ, без которого не может быть жизни, невозможен без участия ферментов, играющих в нем основную роль. Ясно, что ученым необходимо знать сущность процессов обмена веществ прежде всего в здоровом организме.
Используя биологические катализаторы - ферменты, скорости химических реакций можно довести до фантастических пределов. Автоматизация на фабриках синтетической пищи будет основана не только на предельной механизации с помощью машин и приборов. Будет использована и особенность ферментов, которая заключается в том, что белок с его обменом веществ - это автоматически самосовершающийся процесс. Но в ближайшие сотни лет едва ли выгодно заменять бесплатную энергию солнечных лучей другими видами энергии, хотя бы и более мощными, чем солнечное излучение: слишком уж велико количество энергии, необходимой для получения пищевых продуктов*.
*(А. Н. Несмеянов и В. М. Беликов. Проблема синтеза пищи. М., "Наука", 1965.)
Фабриками ферментов являются микробы, пожиратели микробов - фаги и вирусы. Одновременно многие из них приносят человечеству огромное зло (один микроб за сутки может дать 10 миллиардов особей). Химизм одноклеточной бактерии, несмотря на всю его сложность, несравненно проще, чем химические превращения в нашем теле. Кроме того, бактерии - гаплоидные организмы. Все это уже позволило изучать особенности работы ДНК, РНК и ферментов, связанные с передачей наследственности. Несмотря на все своеобразие бактерий (один из примеров - отсутствие в них типичного клеточного ядра), молекулярная биология, изучая их, уже получила много такого, что можно использовать, хотя и с оглядкой, для понимания обмена веществ и его ошибок в нашем теле.
Какую же роль играют ферменты в ошибках обмена веществ? Как мы увидим ниже, ферменты управляют всеми процессами обмена веществ. Причина почти всякого нарушения этих процессов - отсутствие определенного фермента, или избыток его, или же недостаточная активность фермента - все то, что принято обозначать термином "ферментопатия" (энзимопатия).
Приведем все же несколько примеров.
Как уже упоминалось выше, одними из регуляторов обмена веществ являются витамины. Еще недавно считалось, что только в недостатке витамина группы В (никотиновой кислоты) причина когда-то широко распространенного заболевания - пеллагры. Другими словами, пеллагру считали чистейшим авитаминозом. Установить это смогли только после того, как выявили роль ферментов в управлении теми химическими превращениями, которые приводят к образованию никотиновой кислоты. Это не очень сложный путь. Исходным веществом служит триптофан - одна из незаменимых аминокислот. Это своего рода биохимическая репка. И вот начинается: дедка (кинуренин) за репку (триптофан), бабка (оксикинуренин) за дедку, внучка (оксиантраниловая кислота) за бабку. Только "вытаскивают" они не репку, а никотиновую кислоту. И вытаскивают не сами. Каждый этап катализируется соответствующим ферментом, ну а каждый фермент - соответственным геном. Ход этих химических превращений зависит не только от количества субстрата (триптофана), но и от активности и количества ферментов. Особенности действия ферментов обусловлены генетически. У гетерозиготов, например, количество фермента может быть недостаточным или в строении белка-фермента ген допустил ошибку, а в результате - производительность фермента меньше.
Ферментопатия может привести к расстройству обмена на любом из перечисленных выше звеньев. Оказалось, что пеллагру могут вызывать: а) избыток витамина К3, б) болезнь Хартнупа и в) карциноиды (сравнительно доброкачественные опухоли). Разберемся, в чем "виноваты" здесь ферменты?
Витамин К3 и оксиантраниловая кислота "пришлись по вкусу" одному и тому же ферменту. Вернее, он даже отдает предпочтение витамину К3. И вот перед ним избыток этого витамина (введенного в организм с пищей). Тогда фермент затрачивает "все свои силы" на витамин К3, а беспризорная оксиантраниловая кислота не превращается в никотиновую кислоту. В результате возникает авитаминоз.
При болезни Хартнупа ферменты не справляются с реабсорбцией (обратным всасыванием) в почках триптофана. В результате - дефицит этого сырья для производства никотиновой кислоты в нашем теле.
При карциноидах бурно растет число клеток, ферменты которых захватывают большую часть запасов триптофана. Но истощая эти запасы, они опять-таки ограничивают синтез никотиновой кислоты. В результате - пеллагра. Итак, всюду ферменты. Их отсутствие или, наоборот, избыток, их ослабленная или повышенная активность - все это ведет к ферментопатии, к расстройству обмена.
Недостаточность ферментативной активности может быть обусловлена изменением строения ферментного белка в результате мутации соответствующего структурного гена. Но причина может быть и другой: например мутация контролирующего гена, вследствие чего нормальный ферментный белок синтезируется в недостаточном количестве.
Различные наследственные болезни чрезвычайно разнообразны, но если внимательно присмотреться к ним, все это разнообразие можно свести к ошибкам в синтезе белков, в первую очередь белков-ферментов. Доказательства этого мы найдем во всех последующих разделах.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'