Иммунитет и аллергия
(Раздел написан совместно с А. Л. Эйнгорн.)
Общее понятие об иммунитете
Еще в древности было установлено, что человек, перенесший заразное заболевание, вторично им не заболевает. Поэтому таких людей обычно привлекали для ухода за больными и захоронения трупов во время эпидемий. Предпринимались попытки использовать состояние невосприимчивости после перенесенных заболеваний с профилактической целью. Так, для предохранения от заболевания оспой здоровым людям закладывали в нос высушенные оспенные струпья, после чего наступало заболевание в легкой форме и человек становился невосприимчивым к оспе. Но в некоторых случаях возникали тяжелые заболевания, иногда заканчивавшиеся смертью, в связи с чем эти способы не нашли широкого применения.
Как показали наблюдения, люди, переболевшие коровьей оспой, становились устойчивыми к человеческой оспе. Английский врач Э. Дженнер использовал это для создания оспенной вакцины, которая с тех пор получила широкое признание во всем мире. Таким образом была показана возможность искусственного создания невосприимчивости. Однако научное обоснование возможности создания невосприимчивости было сделано значительно позже Л. Пастером. Он показал, что невосприимчивость к инфекционным заболеваниям - бешенству, сибирской язве и др.- можно получить путем введения в организм ослабленных микробов, вызывающих эти болезни.
В настоящее время доказано, что иммунные реакции направлены не только против возбудителей болезней: микробов и вирусов, но против всего чужеродного: чужих клеток и тканей, пересаженных хирургами, генетически изменившихся (в результате мутаций) собственных клеток, в том числе и раковых, т. е. против всего "чужого". Выдающийся австралийский иммунолог Ф. М. Вернет выдвинул представление о том, что в каждом организме существует иммунологический надзор, обеспечивающий распознавание "своего" и "чужого" и уничтожение "чужого".
Теперь иммунитет определяют, как комплекс защитных механизмов, направленных на поддержание постоянства внутренней среды организма, сохранение структуры и функции и защиты его от живых тел и веществ, несущих чужеродную генетическую информацию. Поскольку микробы-тоже чужеродные биологические агенты, то действие иммунных механизмов распространяется и на них.
Механизмы иммунитета разделяются на общие защитные приспособления и специфические, иммунные. Защитными свойствами обладают все живые организмы. Покровные клетки и ткани образуют плотные слои, препятствующие проникновению в организм вредных для него микробов или веществ. Многие организмы вырабатывают вещества, которые смачивают покровные ткани и являются непереносимыми для многих бактерий.
Большое защитное значение имеет фагоцитоз (от phagien - пожираю). Обладающие этой способностью клетки устремляются к бактериям и обволакивают их. Бактерии оказываются заключенными внутри клеток и подвергаются внутриклеточному перевариванию. Фагоцитоз осуществляется также фиксированными тканевыми макрофагами.
Представление о фагоцитозе как защитной реакции организма связано с именем крупнейшего русского ученого И. И. Мечникова. Скопление бактерий внутри лейкоцитов исследователи описывали и раньше. Однако считалось, что в лейкоцитах имеются благоприятные условия для развития микроорганизмов. И. И. Мечников первым дал правильное объяснение сущности и значения фагоцитоза, рассматривая фагоцитарную функцию клеток как нормальный физиологический процесс, сформировавшийся в ходе исторического развития животного мира. У простейших организмов фагоцитоз является не только формой защиты, но и формой пищеварения. У млекопитающих выделяется специальная пищеварительная система, но защита с помощью внутриклеточного переваривания сохраняется. Фагоцитарная защита организма теснейшим образом связана со специфическим иммунитетом.
Иммунная система имеется только у позвоночных. У человека, как и у других млекопитающих, а также у птиц она достигла совершенства. К ней относятся следующие органы: костный мозг, вилочковая железа (тимус), селезенка, лимфатические узлы и вся ретикулярная ткань.
Механизмы неспецифического иммунитета
Неповрежденная кожа здоровых людей - биологический барьер для большинства бактерий. Слизистые оболочки имеют приспособления, обеспечивающие механическое удаление микробов, например движением ресничек эпителия. Защитные свойства слизистых оболочек поддерживаются бактерицидным действием их секрета. В слюне и слезах содержится особое вещество, оказывающее бактерицидное действие,-лизоцим. Слезы даже в разведении 1 : 10 000 могут растворять некоторые микробы. Бактерицидностью слюны объясняется распространенный у всех животных инстинкт вылизывания ран. Защитные свойства пищеварительного тракта связаны с его секреторной деятельностью, высокой кислотностью желудочного сока, бактерицидностью желчи и кишечного секрета.
Защитную роль в организме играет и нормальная бактерицидная флора, содержащаяся в кишечнике, на слизистой оболочке полости носа и рта, половых органов. Например, в кишечнике у здоровых людей всегда имеется кишечная палочка, являющаяся антагонистом многих патогенных микробов, в том числе брюшнотифозных и дизентерийных. Не менее важное значение имеет палочка Дедерлейна для слизистой оболочки влагалища. Палочка Дедерлейна является антагонистом многих патогенных микробов, в том числе гонококка.
Гематоэнцефалический барьер защищает центральную нервную систему от попадания в нее инфекции и чужеродных веществ. Эту защиту осуществляют внутренние барьеры центральной нервной системы - эндотелий капилляров головного мозга и сосудистых сплетений его желудочков. Благодаря функции гематоэнцефалического барьера вредные вещества, попадающие в кровь, не имеют доступа в центральную нервную систему. В этом можно убедиться, если вводить в кровь животного какие-либо красящие вещества. При этом все ткани организма приобретают соответствующую окраску, за исключением мозга, так как в него красящее вещество не проникает из-за гематоэнцефалического барьера, нарушение проницаемости которого имеет важное значение в возникновении патологических процессов в центральной нервной системе.
Роль барьера играет очаг воспаления, возникающего в месте проникновения микробов через кожу или слизистую оболочку (см. главу 9). Если микробы проникают за пределы воспалительного очага или не вызывают воспаления на месте входных ворот инфекции, как, например, при чуме, на их пути оказывается следующий барьер-лимфатическая система. Фагоциты, уничтожая чужеродные для организма частицы, выявляют их антигенные свойства и развивается специфический иммунологический ответ.
При проникновении возбудителя инфекции или чужеродных веществ в кровь в их обезвреживании принимают участие и другие органы: селезенка, печень, костный мозг, а также сыворотка и клетки крови. Эндотелиальные клетки лимфатических узлов, селезенки, костного мозга, звездчатые клетки печени и другие объединены в систему фагоцитирующих мононуклеаров (ретикулоэндотелиальная система).
При инфекциях, вызываемых вирусами, иммунитет обеспечивается главным образом антителами, т. е. веществами, обусловливающими специфические механизмы иммунитета. Антитела могут обезвреживать вирусы, находящиеся только вне клеток. Вирусы же, находящиеся в клетках, действию антител недоступны. Однако клетки не беззащитны в борьбе с вирусом. При контакте с ним в клетках образуется вещество-интерферон, который угнетает внутриклеточное размножение вируса. Интерферон вырабатывается разными клетками. Так, например, при гриппе интерферон вырабатывают клетки слизистых оболочек дыхательных путей. Интерферон-неспецифическое вещество: образуясь под влиянием одного типа вирусов, он активен и в отношении других вирусов.
Механизмы специфического иммунитета
Механизмы специфического иммунитета начинают работать, когда в организме появляется чужеродный антиген, т. е. вещество, вызывающее образование антител или иммунных лимфоцитов. Антителами называют вещества, вырабатываемые организмом, связывающие и обезвреживающие антигены. Выработка антител обеспечивается клетками лимфатической системы. В следующих разделах будут подробнее рассмотрены основные положения об иммунитете. Многое об иммунитете известно и подтверждено убедительными исследованиями, но некоторые аспекты остаются пока гипотезами.
Антигены
Образование антител можно получить путем введения в организм самых разнообразных живых или убитых микробов, вирусов, тканей и клеток другого организма. Не вызывают образования антител только клетки или ткани однояйцевых близнецов или ткани животных одной, специально выведенной линии животных (мышей, кроликов, кур). В остальных случаях ткани даже близких родственников (братьев, сестер, родителей, детей) оказывают антигенное действие.
Антигенным свойством обладают крупные молекулы (макромолекулы) белков, углеводов, нуклеиновых кислот. Эти молекулы состоят из множества более мелких частей, т. е. являются полимерными. Экспериментами установлено, что молекулы с относительной молекулярной массой менее 3000 неиммуногенны. Чем больше относительная молекулярная масса, тем выше антигенная активность вещества. Большинство антигенов, встречающихся в природе, является белками или углеводами.
Искусственно можно получить антитела почти ко всем типам химических соединений, в том числе и к ряду синтетических соединений. Вакцины из убитых возбудителей коклюша, гриппа, брюшного тифа, холеры, не вызывая заболевания, способствуют образованию антител и развитию иммунитета. Для выработки иммунитета против полиомиелита и туберкулеза используют также ослабленные вирусы и бактерии. Для образования противостолбнячного и противодифтерийного иммунитета применяют вакцины, содержащие особым способом обработанный токсин микробов - анатоксин.
В физиологических условиях организм никогда не вырабатывает антител против своих тканей. Однако все ткани обладают свойством антигенности, т. е. они антигенны для любого другого организма. Значит, клетки, способные выработать антитела, могут отличить свои ткани от чужих. По современным взглядам, это обеспечивается тем, что все клетки организма содержат антигены гистосовместимости. Состав этих антигенов имеет видовые и индивидуальные особенности. Говоря об этих антигенах, иммунологи сравнивают их с индивидуальной меткой, имеющейся на любой клетке каждого организма. Считают, что эта "метка" зависит от особенностей цепи нуклеиновых кислот, частицы которой расположены в ином порядке, чем у любого другого существа (подсчитано, что таких вариантов может быть много миллионов). Генетический код всех молекул, образующихся в клетках одного организма, одинаков. Это относится и к антигенам, и к антителам, так как в любой молекуле при ее синтезе повторяются особенности структуры цепи молекулы матрицы-ДНК. Эти молекулы состоят из четырех аминокислотных оснований-аденина, тимина, гуанина и цитолизина, связанных в длинные цепи фосфатными остатками. Синтезироваться могут белки, имеющие разные состав и длину цепей, но генетический код обеспечивает передачу наследственных признаков каждой клетке организма, в том числе и индивидуальной "метки".
Гистосовместимость человека и животных определяется рядом различных генов. Они управляют антигенами, появляющимися на мембранах клеток и имеющими значение генетических "меток". В экспериментах показано, что у мышей имеется 15 - 20 различных антигенов, от которых зависит гистосовместимость. Однако основным из них является антиген, контролируемый локусом Н-2 (Н - гистосовместимость, 2 - потому, что этот локус был открыт вторым). Данный локус обеспечивает формирование наиболее сильного антигена, активно вызывающего иммунитет. У людей соответствующий генетический локус назван HL-A. Если два человека генетически однородны по локусу HL-A, то выживаемость пересаженного от одного к другому трансплантата будет более длительной, чем в случаях, если донор и реципиент отличались по этому локусу. Известно около 50 локусов, имеющих значение для гистосовместимости у людей, но все они образуют антигены, более слабые, чем локус HL-A.
Указывая на то, что в организме не образуются антитела против своих тканей, следует сделать оговорку. В случаях, если в собственных клетках появляется необычный, новый антиген, то против него будут вырабатываться антитела. Это происходит, когда при мутации изменяется генетический код отдельных клеток. Предполагают, что именно это ведет к развитию злокачественных опухолей. Тут и должен вступить в силу "иммунологический надзор" за генетической индивидуальностью организма. Вероятно, большинство клеток, имеющих чужеродную генетическую информацию, должно погибнуть. Однако иногда они начинают быстро расти, вследствие чего формируется опухоль.
Антитела
В ответ на появление в организме антигена образуются антитела. Их можно обнаружить в сыворотке крови. Антитела являются высокоспецифическими белковыми молекулами, которые можно увидеть в электронном микроскопе. Это факторы гуморального иммунитета.
Сыворотка крови человека или животного благодаря антителам приобретает новые свойства по отношению к данному антигену. Например, после заболевания холерой сыворотка крови человека приобретает способность растворять холерные вибрионы. После перенесенной дифтерии или иммунизации дифтерийным анатоксином сыворотка крови обезвреживает токсин, выделенный дифтерийными бактериями.
В настоящее время установлено, что сывороточные антитела - это определенным образом измененные глобулины (белки) крови-иммуноглобулины (Ig). Известно пять классов иммуноглобулинов: IgG, IgA, IgM, IgD, IgE. IgG давно известен как гамма-глобулин. И теперь этим термином пользуются для определения сывороточных антител, применяемых с лечебной целью. Он состоит приблизительно из 1330 аминокислот, имеет молекулярную массу 15 500. К IgG относится самый распространенный класс антител, хорошо обезвреживающий токсины микробов.
IgM - наиболее древний вид антител. Он образуется в организме низших позвоночных. IgM появляется у новорожденных животных, когда они еще не готовы к выработке полноценного иммунного ответа. IgM образуется первым при внедрении в организм возбудителя инфекции- это наиболее быстрый иммунный ответ, как реакция тревоги при возникновении опасности.
В слизистой оболочке носа, дыхательных путей, кишечника секретируется IgA. Он легко проникает через клеточные барьеры и принимает участие в борьбе с возбудителями гриппа и подобных ему вирусных болезней, а также является важным фактором предупреждения проникновения микробов из кишечника в другие ткани и органы.
IgD и IgE пока изучены недостаточно. Известно, что IgE появляется при некоторых формах аллергии.
Кроме гуморальных антител, при иммунных реакциях образуются клеточные антитела, связанные с наружными мембранами клеток-лимфоцитов.
Антителообразующие органы
Специфическая функция лимфатической системы - образование антител, участие в иммунологических реакциях.
Лимфоциты, так же как и другие клетки крови (эритроциты, гранулоциты, моноциты), образуются в костном мозге, лимфатических узлах и селезенке, а затем поступают в кровоток. Считают, что все эти клетки развиваются из общего предшественника - стволовой клетки. Лимфоциты - это специфические клетки иммуногенеза. Только они и образующиеся из них плазматические клетки, проходя определенные стадии преобразования, вырабатывают антитела.
Все другие лейкоциты также имеют защитное значение. Нейтрофилы (полиморфонуклеары) первыми вступают в борьбу с возбудителями инфекций. Это активные фагоциты. Эозинофилы также являются фагоцитами. Базофилы содержат крупные гранулы, которые легко разрываются и выделяют вещества, усиливающие воспаление.
Моноциты (мононуклеарные лейкоциты) представляют собой иной вариант фагоцитов. Это очень мобильные фагоцитирующие клетки крови, которые легко проникают в ткани и там развиваются в большие по размеру тканевые фагоциты, называемые макрофагами. Они встречаются в значительном количестве в лимфатических узлах, селезенке, печени и могут быть в любых других органах.
Лимфатические узлы (рис. 2) являются коллекторами, в которые поступает лимфа из тканей по тканевым щелям, лимфатическим сосудам. Лимфатические узлы образуют цепь, тянущуюся до впадения сосудов в грудной проток и венозную систему. В этой цепи происходят фильтрация лимфы, удаление из нее чужеродных частиц, выработка антител и иммунных лимфоцитов. Лимфатический узел - это динамическая система, в которую все время поступают и выходят клетки. При инфекции лимфатические узлы резко набухают, что является показателем их активной функции. В это время в фолликулах появляются центральные зоны, состоящие из крупных, быстро делящихся лимфоцитов.
Близки по структуре к лимфатическим узлам пейеровы бляшки тонкого кишечника и солитарные фолликулы толстого кишечника. Они не имеют приводящих сосудов: дренаж лимфы происходит в них непосредственно из стенок кишки. Особое значение данных образований заключается в выработке IgA-обезвреживающего вещества, всасывающегося из кишечника.
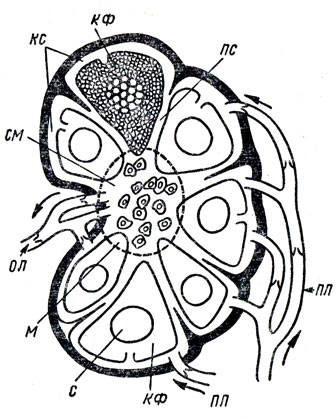
Рис. 2. Строение лимфатического узла (схема). ПЛ - приводящий лимфатический сосуд; ОЛ - отводящий лимфатический сосуд; КС - краевой синус; ПС - промежуточный синус; СМ - синус мозгового слоя; КФ - кортикальный фолликул; С - светлый центр; М - мякотный шнур
Селезенка по строению похожа на лимфатические узлы. В белой пульпе имеются лимфатические фолликулы. Помимо антителообразующей функции, селезенка удаляет из тока крови старые и распадающиеся эритроциты; в ней они разрушаются (красная пульпа).
Вилочковая железа (тимус, или зобная железа) долго являлась загадкой, поскольку ее функция не была изучена. Лишь в последние годы выявлено, что вилочковая железа имеет огромное значение в формировании иммунитета. Гистологически в ней удается выделить три группы клеток: лимфоциты, клетки соединительнотканной стромы и клетки, похожие на эпителиальные. Лимфоциты вилочковой железы называют Т-лимфоцитами, однако на гистологических и цитологических препаратах они не отличаются от других лимфоцитов. По функциональным свойствам удается различать две группы лимфоцитов. Одни называют В-лимфоцитами (бурсазависимыми), другие - Т-лимфоцитами (тимусзависимыми).
Образование В-лимфоцитов от вилочковой железы не зависит. У птиц развитие этих лимфоцитов связано с фабрициевой сумкой (бурсой-В). У млекопитающих такой сумки нет. Предполагают, что ее заменяют костный мозг, червеобразный отросток или пейеровы бляшки кишечника. Чтобы выработать антитела, В-лимфоциты должны взаимодействовать с Т-лимфоцитами. Так, иммунологи обнаружили новое явление - кооперацию клеток.
В последние годы появились работы, свидетельствующие о том, что в развитии иммунных реакций определенную роль играют печень и легкие.
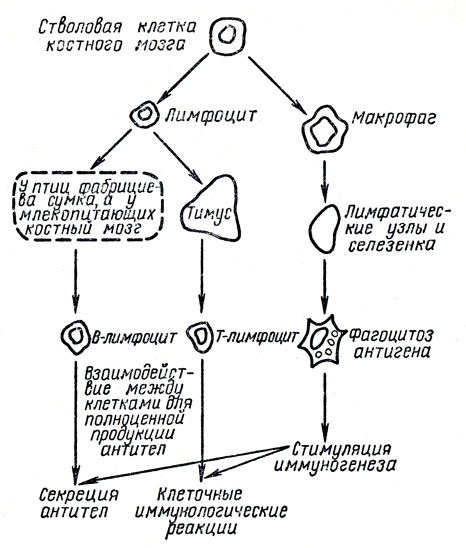
Рис. 3. Взаимодействие клеток при иммунном ответе (схема)
Взаимодействие клеток при иммунном ответе
Современное представление о механизме иммунного ответа основано на многочисленных исследованиях, и эти представления непрерывно расширяются.
При поступлении антигенов в организм их в первую очередь фагоцитируют макрофаги лимфатических узлов. Здесь же в лимфатических узлах имеются Т- и В-лимфоциты, которые стимулируются антигенами, переработанными в фагоцитах. В-лимфоциты начинают быстро делиться и превращаются в плазматические клетки, которые продуцируют поливалентные антитела IgM, а через 2 - 3 сут-строго специфические антитела IgG. Это является одной из форм взаимодействия - кооперации клеток в иммуногенезе (рис. 3).
Существует и вторая форма взаимодействия. Т-лимфоциты лимфатических узлов и селезенки - это клетки, прошедшие "обучение" в вилочковой железе. Они, также как и В-лимфоциты, происходят из стволовых клеток костного мозга, но, после того как попадут в вилочковую железу, приобретают новые свойства и расселяются в лимфатических узлах и селезенке. Эти клетки сами не вырабатывают свободных антител, но Т-лимфоциты обусловливают развитие реакции клеточного иммунитета.
Часть лимфоцитов при этих процессах сохраняется в лимфоидной ткани и превращается в клетки иммунологической памяти, надолго сохраняя информацию о чужеродном антигене. При повторном поступлении того же антигена в организм клетки памяти активируются, делятся и быстро превращаются в иммунокомпетентные - принимающие активное участие в выработке антител или в развитии клеточного иммунитета.
В развитии иммунологических реакций большое значение имеют комплемент и некоторые особенности взаимодействия клеток, антигена и антител, такие, как хемотаксис, мембранолиз, преципитация, агглютинация.
Комплемент - это система сывороточных протеинов. Известно несколько видов комплемента. Значение комплемента состоит в том, что он усиливает эффект взаимосвязи между антителом и антигеном. В присутствии комплемента реакция антиген - антитело протекает с преципитацией и агглютинацией. Комплемент способствует фагоцитозу вследствие того, что усиливает хемотаксис, мембранолиз, иммунное сцепление.
Хемотаксис - это свойство фагоцитирующих клеток направляться к объекту фагоцитоза. Вещества, вызывающие хемотаксис, являются некоторыми компонентами комплемента. Однако химическая природа этих веществ не изучена.
Мембранолиз - разрушение, или растворение, наружных мембран клеток, происходит под влиянием комплексов антиген-антитело - комплемент. Особенно чувствительны к такому повреждению грамотрицательные бактерии.
Преципитация-это выпадение из раствора крупномолекулярных комплексов. В присутствии комплемента антитела связывают антигены. Каждое антитело чаще всего бывает двухвалентным и может быть связано с двумя антигенами. Антигены не могут быть связаны с несколькими антителами. При равном количестве антигенов и антител образуются решетки, состоящие из комплексов антиген - антитело. Такие решетки представляют собой очень крупные молекулы и выпадают из растворов в осадок. В организме же формируются макромолекулярные комплексы, которые могут подвергаться фагоцитозу. При избытке антител или антигенов такие решетки не образуются и комплексы антиген-антитело не приобретают больших размеров.
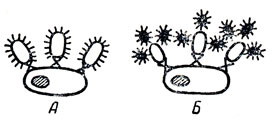
Рис. 4. Флюоресцентное выявление антигенов и антител (схема). А - прямой метод: выявляются антигены при помощи меченых антител. Б - непрямой метод; используются меченые антитела, являющиеся специфическими антигамма-глобулинами (антителами)
Агглютинация очень близка к преципитации. Различие состоит в том, что реакция агглютинации происходит со взвешенными частицами антигена (микроорганизмами, клетками крови и др.), а не с растворимыми молекулами.
На вооружении иммунологов имеется ряд способов выявления антигенов. Наиболее широко применяют с этой целью реакции преципитации и агглютинации, позволяющие обнаружить антигены в жидкостях. Для выявления антигенов и антител внутри тканей наиболее распространены методы флюоресцентной микроскопии. Антитела могут быть соединены с красками, светящимися в ультрафиолетовых лучах. При освещении ультрафиолетовыми лучами гистологических препаратов, приготовленных из тканей, в которые были введены такие антитела, начинают светиться места расположения меченых антител (рис. 4). Уточнить места расположения антител и антигенов на клетках удается и при помощи электронной микроскопии. Для этого применяется метод, когда антитела метят ферритином или ферментами, например пероксидазой хрена, расположение которых видно при электронной микроскопии.
Клеточный иммунитет. Клеточные иммунные реакции известны давно, но современное представление о механизме клеточного иммунитета базируется на новых фактах. Клеточные иммунные реакции имеют ведущее значение в проявлениях несовместимости тканей, обусловливают реакции замедленной гиперчувствительности, устойчивость к опухолям и многим инфекционным заболеваниям, имеют большое значение в развитии аутоиммунных процессов.
Под влиянием многих антигенов происходит пролиферация Т-лимфоцитов, на клеточных оболочках которых имеются специфические рецепторы, способные связывать данный антиген. Эти рецепторы представляют собой особый тип антител, связанных с оболочкой клетки. В этом их отличие от антител, вырабатываемых плазматическими клетками и выделяемыми ими в виде иммуноглобулинов. Если организм неспособен к клеточному иммунитету, то он нежизнеспособен. Это встречается при врожденной аплазии вилочковой железы, а в экспериментах возможно при удалении ее в эмбриональном периоде. Без Т-лимфоцитов утрачивается способность иммунологического контроля за генетической целостностью организма.
Т-лимфоциты являются единственными клетками, способными обеспечить развитие клеточных иммунных реакций. Однако присутствие макрофагов необходимо для передачи информации об антигенах и стимуляции клеточного иммунитета. По-видимому, макрофаги, фагоцитируя антиген, вырабатывают вещества, информирующие иммунокомпетентиую систему и стимулирующие лимфоциты при иммунологических реакциях.
Реакции гиперчувствительности замедленного типа представляют классический пример нарушения клеточного иммунитета. Если при сенсибилизации организма внутрикожно ввести туберкулин, то на месте инъекции появляются покраснение и уплотнение. Медленно распространяясь, становится максимальным через 48 - 72 ч. В начале реакции в зоне уплотнения появляются неитрофилы, но в разгар ее больше всего обнаруживается лимфоцитов и различных фагоцитов. Исчезает реакция также медленно, в течение нескольких дней. Реакции гиперчувствительности замедленного типа, вызванные другими антигенами, и реакции отторжения чужеродного тканевого трансплантата протекают примерно так же.
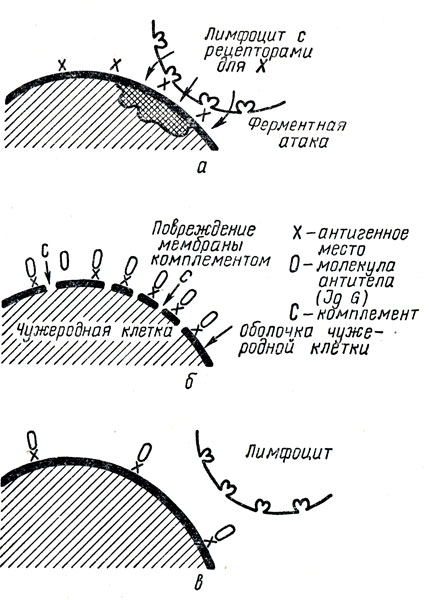
Рис. 5. Взаимодействие иммуноглобулинов и иммунных лимфоцитов с чужеродными клетками (схема). А - повреждение клетки; б - лизис клетки под влиянием иммуноглобулинов; в - феномен усиления
Т - зависимые лимфоциты осуществляют постоянный и очень эффективный надзор за появлением генетически чужеродных клеток в организме. Вначале происходит сенсибилизация Т - лимфоцитов. Сенсибилизированные Т - лимфоциты вступают в прочный контакт с инородными клетками при помощи специфических иммунологических рецепторов (рис. 5). Они соединяются с антигенами, расположенными на поверхности чужеродных клеток. При этом лимфоциты выделяют цитотоксические вещества, которые повреждают мембраны клеток и вызывают их гибель (рис. 5, а). У иммунологов принято называть клетки с антигенными детерминантами клетками-мишенями: их поражают Т - лимфоциты - Т - киллеры (клетки-убийцы). В последние годы получены убедительные данные о том, что среди Т - лимфоцитов имеются клетки с разной функцией. Кроме Т - киллеров, есть Т - хелперы (клетки-помощники), выполняющие роль посредников во взаимодействиях с В - клетками. В селезенке, костном мозге имеется много Т - супрессоров (клетки-угнетатели), подавляющих интенсивность иммуного ответа. Предполагают, что значение этих клеток очень велико в саморегуляции процессов иммунного ответа. Ограничивая интенсивность иммунного ответа, они предупреждают повреждение собственных тканей, т. е. защищают их от аутоиммунных повреждений. Расстройства этой защиты возникают при некоторых патологических состояниях, и тогда развивается повреждение собственных тканей организма.
Однако в организме чужеродные клетки иногда погибают и под влиянием гуморальных антител - иммуноглобулинов. Вместе с комплементом эти антитела могут вызвать лизис (расплавление) чужеродных клеток (рис. 5, б). Иногда с антигеном реагируют и антитела, и Т-лимфоциты. Если чужеродная клетка имеет редко расположенные антигенные детерминанты (рис. 5, в), то они все могут быть заняты молекулами антител. Их количество оказывается недостаточным для лизиса, а Т - лимфоциты уже не могут поразить эти клетки, так как все антигенные места заняты. Данный феномен назван усилением. В таких случаях чужеродные клетки сохраняют жизнеспособность, как, например, при развитии опухолей. Феномен усиления может быть вызван искусственно, например при трансплантации тканей.
Трансплантационный иммунитет
Трансплантационный иммунитет занимает особое место иммунологии. В экспериментах установлено, что аутологичный (т. е. свой) орган или ткань после пересадки может приживаться и нормально функционировать. Орган, взятый от другого организма того же (аллогенный) или другого (ксеногенный)* вида, подвергается отторжению.
* (По старой терминологии соответственно гомологичный и гетерогенный. )
Отторжение наступает в результате иммунологического "конфликта" между реципиентом (хозяином) и трансплантатом. Ткань животных одного вида, даже родственных, имеет свою генетическую специфичность. Это ведет к тому, что организм реципиента реагирует на трансплантат как на чужеродную ткань. Особенностью трансплантационного иммунитета является то, что в нем основное значение имеют механизмы клеточного иммунитета.
Лишь в первые двое суток гомотрансплантат еще не воспринимается организмом как чужеродный и в кожных гомотрансплантатах может восстановиться кровообращение. Однако уже через 48 ч в трансплантате появляются макрофаги, а через 4 - 9 дней происходит инфильтрация трансплантата иммунными лимфоцитами. Лимфоциты-киллеры разрушают клетки трансплантата. Одновременно происходит тромбоз сосудов трансплантата и он отторгается. При этом погибают и лейкоциты, инфильтрирующие трансплантат. При гибели лейкоцитов освобожденные ферменты лизосом лизируют клетки трансплантата. Это реакция организма-хозяина против трансплантата.
При повторных трансплантациях от одного и того же донора организм оказывается сенсибилизированным и тогда отторжение происходит гораздо быстрее - через 24 - 48 ч, т. е. в те же сроки, что и реакция гиперчувствительности замедленного типа.
Трансплантационная иммунология позволила изучить ряд закономерностей механизмов развития данного проявления иммунитета. Одной из таких закономерностей является то, что у животных в эмбриональном периоде развития и в первые дни после рождения лимфоидная ткань еще не готова к иммунологическому ответу. Поэтому новорожденные не имеют активного иммунитета. Готовность к иммунологическим ответам наступает лишь через несколько дней после рождения. Это делает понятным значение врожденного пассивного иммунитета, возникающего в результате поступления антител от матери через плаценту, а после рождения - с молоком.
Отсутствие у эмбрионов и новорожденных готовности к иммунному ответу было использовано в экспериментах для создания искусственной толерантности. Толерантность - это отсутствие способности организма реагировать на определенные антигены. Согласно теории, выдвинутой австралийским ученым Ф. Бернетом, иммунный надзор за генетической целостностью организма осуществляется клонами лимфоцитов, вырабатывающих антитела против огромного количества различных антигенов. В период формирования лимфатической системы клоны, способные вырабатывать антитела против собственных тканей организма, погибают. Сохраняется лишь клон, приобретающий толерантность к собственным антигенам. Это обеспечивает распознавание лимфоидной системой всего "чужого" и отсутствие реакции на "свое". Если же в период, когда лимфоидная ткань еще не полностью созрела, ввести чужеродные антигены, то клоны, способные реагировать на них, также погибают и создается толерантность по отношению к этим антигенам. Ф. Бернет обосновал это положение теоретически, а английский ученый П. Медавар подтвердил в эксперименте, за что оба они в 1960 г. были удостоены Нобелевской премии.
С трансплантационным иммунитетом тесно связана реакция организма - хозяина против трансплантата. Наиболее грозной эта реакция бывает в случаях, когда производится трансплантация иммунокомпетентных тканей - костного мозга, селезенки, лимфоцитов-реципиенту (организму, воспринимающему трансплантат), у которого угнетена иммунологическая защита, например после рентгеновского облучения. При отсутствии иммунной защиты в организме-хозяине пересаженные в него клетки могут приживаться, размножаться и принимать участие в иммунной атаке против тканей реципиента. Существуют различные формы проявления вторичной трансплантационной болезни. Она может протекать очень тяжело и даже вызвать гибель реципиента.
Аутоиммунные повреждения
Аутоиммунные процессы возникают в тех случаях, когда в организме вырабатываются антитела против собственных тканей. В этих условиях могут возникнуть аутоиммунные болезни под влиянием антигенов, которые образуются при повреждении тканей, некрозах, ишемии, дистрофических процессах, многих инфекциях и при других заболеваниях, ведущих к повреждению тканей.
Создание экспериментальных моделей аутоиммунных заболеваний помогло выяснить, что в патогенезе таких болезней, как ревматизм, гломерулонефрит, сахарный диабет и др., аутоиммунное повреждение оказывается главным звеном.
Доказательствами аутоиммунного процесса считаются, во-первых, присутствие аутоантител против одного или нескольких видов своих тканей; во-вторых, увеличение в связи с этим количества иммуноглобулинов в сыворотке крови; в-третьих, накопление в пораженных тканях лимфоцитов и плазматических клеток; в-четвертых, улучшение состояния больных при лечении иммунодепрессивными препаратами, угнетающими функцию лимфоидной ткани.
Аллергия и анафилаксия
Аллергия (от alios - другой, ergia - действие) - измененная реактивность организма к антигенам. В отличие от физиологической иммунной реакции-иммунитета в данных случаях развивается повышенная чувствительность к антигену - аллергену. Склонность к аллергическим реакциям может передаваться по наследству.
Аллергические реакции могут проявляться в виде местных или общих реакций. Классическим примером местной аллергической реакции является феномен Артюса, заключающийся в следующем. Если под кожу кролика ввести 0,3 - 0,5 мл лошадиной сыворотки, то на месте инъекции появляется небольшая, быстро проходящая воспалительная реакция. Если такие инъекции повторять с интервалом в 5 - 6 дней, то после 4 - 5 инъекций воспаление становится бурным и введенная сыворотка рассасывается медленно, а затем, после 5 - 6-кратного введения сыворотки, на месте инъекции развивается некроз тканей. Таким образом, после предварительной подготовки животного-сенсибилизации у него на месте введения сыворотки развивается патологическая реакция. Сенсибилизация повысила чувствительность животного к повторному введению этого же вещества.
Около 10% всех людей страдает аллергией различной формы: в виде сенной лихорадки, крапивницы, отеков, бронхиальной астмы и др.
В основе повышенной чувствительности организма лежат его иммунные реакции на антиген. Обычно такая чувствительность проявляется при повторной встрече организма с аллергеном, не вызывающим у здоровых людей реакции. Однако с первой встречи с аллергеном начинается образование аллергических антител, которые после повторной встречи с тем же аллергеном дают бурную цепную реакцию. Механизм этой реакции недостаточно ясен; одной из главных ее особенностей являются распад тучных клеток и выход из их гранул гистамина. Гистамин вызывает расширение сосудов и отек тканей.
К типичным аллергенам относятся различные виды пыльцы трав и цветов, перья некоторых видов птиц, шерсть домашних животных, различные красители. Аллерген проникает в организм чаще всего через слизистую оболочку дыхательных путей или кожу.
Анафилаксией называют реакцию повышенной чувствительности к повторному введению чужеродного белка. Анафилаксия может проявляться реакцией организма различной степени вплоть до крайне тяжелой- анафилактического шока.
Экспериментально анафилактический шок легко продемонстрировать на морских свинках, очень чувствительных к чужеродным белкам. Если морской свинке подкожно ввести небольшую дозу (0,01 - 0,001 мл) чужеродного белка, например лошадиной сыворотки, то свинка легко переносит это без всяких видимых последствий. К 8 - 12-му дню у морской свинки развивается состояние сенсибилизации по отношению к введенному белку. Если в период сенсибилизации морской свинке ввести в кровь тот же белок, развивается анафилактический шок. Для развития анафилаксии необходимо введение в кровь большой дозы этого же антигена. Это так называемая разрешающая инъекция. А. М. Безредка ярко описал картину анафилактического шока у морской свинки: "Как только кончено пробное вспрыскивание, сенсибилизированная морская свинка начинает волноваться. Она начинает царапать мордочку. Ее волнение растет с минуты на минуту. Вдруг она начинает вращаться вокруг своей оси. Эти вращательные движения прерываются судорожными вздрагиваниями, все более частыми и сильными. В определенный момент - 3 - 4 мин спустя после вспрыскивания - судорожные движения становятся реже. Животное кажется истощенным... Ложится на бок. Сфинктеры мочевого пузыря и заднего прохода расслабляются; происходит выделение мочи и кала. Дыхание, очень короткое и прерывистое сначала, становится все медленнее. К концу короткого промежутка, редко превышающего 5 - 6 мин, животное умирает от удушья".
Если анафилаксия проявляется в слабой форме, то обычно наблюдаются зуд, учащенное дыхание, сердцебиение, понижение артериального давления и понос.
В отдельных случаях животные при анафилактическом шоке выживают. В дальнейшем они на некоторое время становятся нечувствительными к данному аллергену. Наступает так называемая десенсибилизация. Десенсибилизацию можно вызвать искусственно, вводя перед инъекцией разрешающей дозы небольшую дозу аллергена.
Анафилаксию разной степени тяжести можно наблюдать у людей, например при повторном введении различных лечебных сывороток-противостолбнячной, противодифтерийной и др. Описаны случаи анафилактического шока при повторном введении антибиотиков, анестетиков или витаминов. Для предупреждения анафилактических реакций в практике используют метод десенсибилизации, предложенный А. М. Безредкой: за 2 - 4 ч перед введением необходимого количества сыворотки вводят небольшую ее дозу (0,5 - 1 мл). Этот метод обычно делает введение сыворотки безопасным. Однако у особо чувствительных людей даже применение этого метода не всегда предупреждает развитие анафилаксии.
К анафилаксии относится сывороточная болезнь, развивающаяся у некоторых людей через 8 - 14 сут после введения лечебных сывороток. Она характеризуется появлением зуда, сыпи, повышением температуры, отеком лица. Обычно через несколько дней наступает выздоровление.
Развитие сывороточной болезни можно ослабить или иногда предупредить, если вводить сыворотку не сразу, а постепенно возрастающими дозами. Хорошо очищенная сыворотка реже вызывает сывороточную болезнь.
К аллергическим реакциям относят повышенную чувствительность к аллергенам бактериальной природы. Это реакции гиперчувствительности замедленного типа. Возникновение реакции такого типа связано с предшествующей сенсибилизацией организма микробным аллергеном, вирусом, токсином. В ответ на эти аллергены могут развиваться реакции клеточного иммунитета без образования гуморальных антител. Этим объясняется то, что при реакции замедленного типа обычно отмечаются значительные местные повреждения тканей.
Аллергические реакции играют важную роль в патогенезе многих заболеваний, особенно туберкулеза, скарлатины, ревматизма. Так, например, при туберкулезе организм больного постоянно сенсибилизирован по отношению к туберкулезному токсину - туберкулину. Организм здорового человека не реагирует на внутрикожное введение туберкулина или отвечает легкой воспалительной реакцией. Введение же туберкулина больным туберкулезом вызывает бурную кожную воспалительную реакцию. Эта проба используется с диагностической целью.
Аллергические проявления часто определяют характер течения болезни. Разрешающими факторами могут быть самые разнообразные воздействия, иногда даже случайные. Так, например, обострение ревматизма может начаться после гриппа, ангины, охлаждения или перегревания, а также после введения лечебной сыворотки (например, противостолбнячной). Обострение хронически текущего туберкулезного процесса иногда происходит после различных воздействий, изменяющих реактивность организма и играющих роль разрешающих факторов.
Лекарственная аллергия развивается вследствие повышенной чувствительности некоторых лиц к определенным лекарственным препаратам или в результате сенсибилизации этими препаратами. Роль антигена в таких случаях может выполнять как сам препарат, например некоторые антибиотики, так и продукты, образующиеся в результате взаимодействия данного препарата с белками организма. Чаще всего аллергические реакции вызывают антибиотики, но эти реакции могут быть обусловлены и другими лекарственными средствами, даже амидопирином.
Клинические проявления аллергических реакций на лекарственные препараты разнообразны-от крапивницы или приступа бронхиальной астмы до анафилактического шока. В связи с этим для предупреждения аллергических реакций лекарственные препараты следует применять только при определенных показаниях по правильным схемам и после выяснения переносимости их данным больным.
Подобно лекарственным аллергиям, могут развиваться аллергии в ответ на раздражение некоторыми химическими веществами, например лаками, красителями, клеями. В таких случаях чаще всего приходится встречаться с аллергическими поражениями кожи-дерматитами.
К аллергии относится и идиосинкразия - сверхчувствительность к некоторым пищевым продуктам, лекарственным препаратам, вдыхаемой пыльце цветов, косметическим средствам и т. п.
ПОИСК:
© ANFIZ.RU, 2011-2022
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'
При использовании материалов сайта активная ссылка обязательна:
http://anfiz.ru/ 'Анатомия и физиология человека'